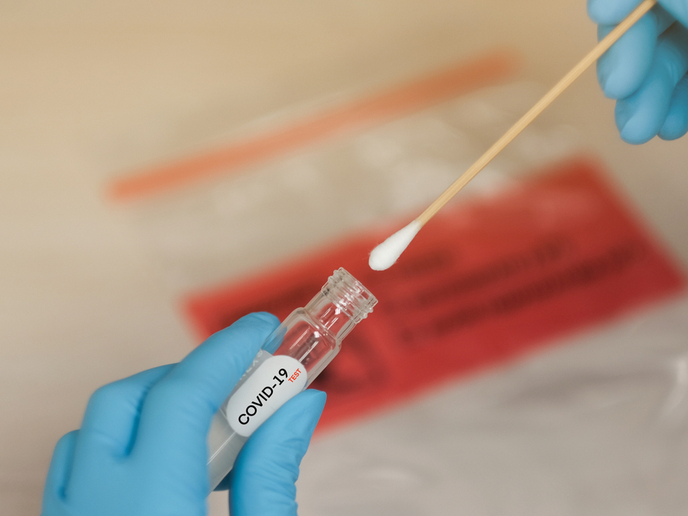
Prueba rápida para la COVID-19 con aprobación europea
Aunque las pruebas para el coronavirus están aumentando por todo el mundo, la cuestión de la rapidez y la fiabilidad de diagnóstico sigue siendo un desafío para las autoridades de salud pública. Un grupo de investigación que cuenta con el apoyo del proyecto financiado con fondos europeos HG nCoV19 test ha desarrollado una prueba que permite un diagnóstico rápido de la COVID-19 en un estadio temprano, cuando es sumamente contagiosa. Puede detectar la presencia del virus en treinta minutos y proporciona resultados negativos en sesenta. «Cuando se combina con un método de extracción de ácido nucleico, el sistema proporciona una sensibilidad equivalente a la de los sistemas actuales de reacción en cadena de la polimerasa (PCR) para muestras de individuos en todos los estadios de la infección por COVID-19», afirma la empresa coordinadora del proyecto, HiberGene Diagnostics, en una nota de prensa. La empresa añade que «ha completado con éxito el marcado CE de una nueva prueba molecular rápida para la COVID-19, que ya está disponible para su venta en Irlanda y el resto del mundo». Y señala: «Este anuncio sigue a la finalización de un estudio de evaluación clínica en el hospital Mater Private de Dublín (Irlanda), que ha demostrado la eficacia del producto». El marcado CE indica que un producto ha sido evaluado por el fabricante y que cumple los requisitos de seguridad, salud y protección medioambiental de la Unión Europea (UE). Es necesario para productos fabricados en cualquier parte del mundo y comercializados en la UE. Según la misma nota de prensa: «Gracias a un protocolo de preparación de muestras de baja complejidad, la prueba tiene un rendimiento excelente para muestras con una carga viral entre alta y moderada». «Está previsto realizar más estudios y colaboraciones, junto con evaluaciones clínicas, para evaluar otros usos potenciales de la prueba, como la compatibilidad con nuevos tipos de muestras y cohortes de pacientes», señala, a lo que añade que se realizarán en China, Italia e Irlanda del Norte.
A distancia y en laboratorio
La prueba puede llevarse a cabo tanto en instalaciones descentralizadas en las que es necesario realizar pruebas moleculares rápidas de cribaje, como en laboratorios centralizados en los que es frecuente que haya que realizar pruebas adicionales de confirmación o pruebas en horario no laboral. Según la nota de prensa de la empresa: «La nueva prueba para la COVID-19, que amplía la gama de productos de la empresa a trece pruebas, emplea el formato reactivo molecular patentado de HiberGene para detectar con precisión el virus en muestras tomadas en nariz y garganta, y utiliza el instrumento pequeño y portátil HG Swift de HiberGene para analizar cuatro muestras a la vez». Citada en la misma nota de prensa, Mariya Gabriel, comisaria de Innovación, Investigación, Cultura, Educación y Juventud, comenta: «Es fundamental diagnosticar el coronavirus con mayor rapidez y fiabilidad, ya que su diagnóstico reduce el riesgo de que siga propagándose». Está previsto que el proyecto en curso HG nCoV19 test (Development and validation of rapid molecular diagnostic test for nCoV19) concluya en agosto de 2021. Para más información, consulte: proyecto HG nCoV19 test
Palabras clave
HG nCoV19 test, coronavirus, COVID-19, diagnóstico, salud