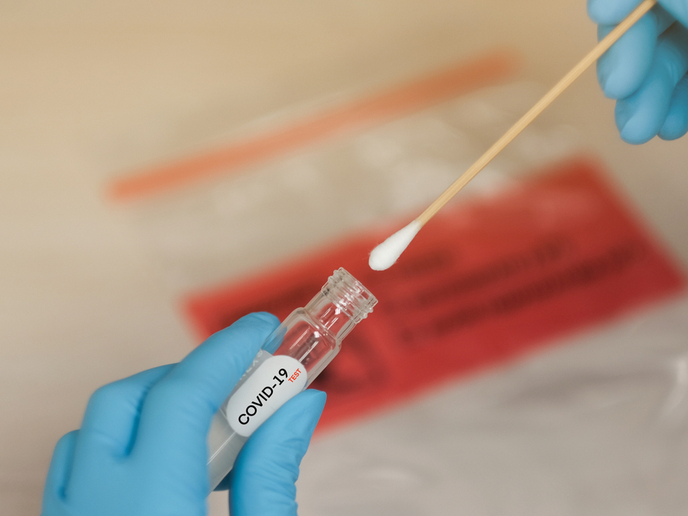
COVID-19-Schnelltest erhält EU-Zulassung
Auch wenn Testungen auf das Coronavirus überall auf der Welt immer weiter ausgebaut werden, stellen Schnelligkeit und Genauigkeit immer noch eine Herausforderung für die Gesundheitsbehörden dar. Ein Wissenschaftsteam hat – unterstützt durch das EU-finanzierte Projekt HG nCoV19 test (Development and validation of rapid molecular diagnostic test for nCoV19) – einen Test zur Schnelldiagnose von COVID-19 im frühen, hochinfektiösen Stadium entwickelt. Der Test kann das Vorhandensein des Virus innerhalb von 30 Minuten detektieren. Negative Ergebnisse liegen innerhalb von 60 Minuten vor. „In Verbindung mit einem Nukleinsäuren-Extraktionsverfahren bietet der Test die gleiche Sensitivität wie das gegenwärtige PCR-Verfahren [Polymerase-Kettenreaktion] für Proben in allen Stadien einer COVID-19-Infektion“, heißt es in einer Pressemitteilung des Unternehmens HiberGene Diagnostics, dem Projektkoordinator. Das Unternehmen fügt hinzu, dass „es die CE-Kennzeichnung für einen molekularen COVID-19-Schnelltest erhalten hat, der ab sofort in Irland und international auf dem Markt erhältlich ist.“ Weiter heißt es: „Diese Bekanntmachung erfolgt nach dem Abschluss einer klinischen Evaluierungsstudie am Mater Private Hospital in Dublin, Irland, bei der die Wirksamkeit des Tests nachgewiesen werden konnte.“ Die CE-Kennzeichnung zeigt an, dass ein Produkt vom Hersteller einem Bewertungsverfahren unterzogen wurde und den geltenden EU-Richtlinien bezüglich Sicherheit, Gesundheit und Umweltschutz entspricht. Es ist für weltweit hergestellte Produkte erforderlich, die in der EU vermarktet werden sollen. „Unter Anwendung eines leicht zu handhabenden Proben-Protokolls liefert der Test ausgezeichnete Ergebnisse bei Proben mit hohen bis moderaten Viruskonzentrationen“, so die Pressemitteilung. „Weitere Studien und Kooperationen zur Bewertung eines möglichen zusätzlichen Einsatzes des Tests, wie z. B. die Kompatibilität mit neuen Probenarten und Patientenkohorten, sind einschließlich klinischer Bewertungen geplant“, heißt es weiter. Diese werden in China, Italien und Nordirland durchgeführt.
Dezentral sowie laborbasiert
Der Test kann sowohl an dezentralen Standorten eingesetzt werden, an denen molekulare Schnelltests für Screenings benötigt werden, als auch in zentralen Laboren, in denen häufig zusätzliche Tests zur Bestätigung oder Tests außerhalb der üblichen Arbeitszeiten durchgeführt werden müssen. „Beim neuen COVID-19-Test, der die Produktpalette des Unternehmens auf 13 Tests erweitert, wird das firmeneigene molekulare Reagenzformat eingesetzt, um das Virus präzise in Rachen- und Nasenabstrichen zu detektieren. Dabei wird ein kleines, tragbares Gerät von HiberGene verwendet, der HG Swift, mit dem vier Proben gleichzeitig getestet werden können“, wie in der Pressemitteilung des Unternehmens erklärt wird. Mariya Gabriel, EU-Kommissarin für Innovation, Forschung, Kultur, Bildung und Jugend, wird in derselben Pressemitteilung folgendermaßen zitiert: „Es ist entscheidend, das Coronavirus schneller und genauer zu diagnostizieren, weil dies das Risiko einer weiteren Verbreitung des Virus reduziert.“ Das laufende Projekt HG nCoV19 test soll im August 2021 enden. Weitere Informationen: Projekt HG nCoV19 test
Schlüsselbegriffe
HG nCoV19 test, Coronavirus, COVID-19, Diagnostik, Gesundheit