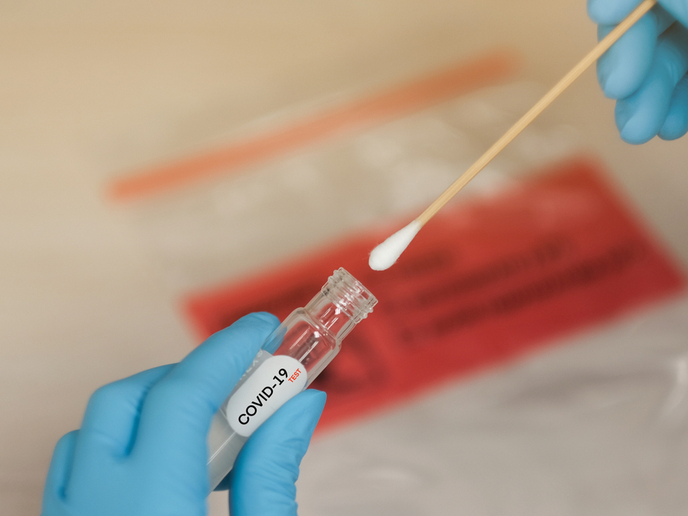
Un test rapido per la COVID-19 ha ottenuto l’approvazione dell’UE
Sebbene i test per il coronavirus siano in aumento in tutto il mondo, il problema della velocità e della precisione della diagnosi continua a costituire una sfida per le autorità sanitarie. Un gruppo di ricerca sostenuto dal progetto HG nCoV19 test, finanziato dall’UE, ha sviluppato un test che permette una rapida diagnosi della COVID-19 nel suo stadio iniziale altamente contagioso. Il test è in grado di rilevare la presenza del virus in 30 minuti, mentre i risultati negativi vengono forniti in 60 minuti. «Quando associato a un metodo di estrazione dell’acido nucleico, il sistema ha una sensibilità equivalente a quella degli attuali sistemi di PCR [reazione a catena della polimerasi], per i campioni di individui con un’infezione da COVID-19 a qualsiasi stadio», come affermato da HiberGene Diagnostics, coordinatore del progetto, in un comunicato stampa. L’azienda aggiunge che «ha completato con successo la procedura per l’ottenimento della marcatura CE di un nuovo test molecolare rapido per la COVID-19, ora disponibile per la vendita in Irlanda e a livello internazionale». Nel comunicato si evidenzia: «Questo annuncio segue il completamento di uno studio di valutazione clinica all’Ospedale Mater Private di Dublino, in Irlanda, che ha dimostrato l’efficacia del prodotto». La marcatura CE indica che un prodotto è stato sottoposto a valutazione dal produttore ed è stato ritenuto corrispondente ai requisiti UE per la sicurezza, la salute e la protezione dell’ambiente; è necessaria per prodotti fabbricati in qualsiasi parte del mondo successivamente commercializzati nell’UE. «Impiegando un protocollo di preparazione del campione poco complesso, il test ottiene risultati eccellenti per campioni con cariche virali da alte a moderate», riporta il medesimo comunicato stampa. «Sono in programma altri studi e collaborazioni, incluse delle valutazioni cliniche, per verificare potenziali ulteriori impieghi del test, quali la compatibilità con nuove tipologie di campione e coorti di pazienti», si afferma nel comunicato, aggiungendo che tali valutazioni cliniche verrano effettuate in Cina, Italia e Irlanda del Nord.
Da remoto e in laboratorio
Il test può essere impiegato sia in strutture decentralizzate che necessitano di test molecolari rapidi per gli screening, sia in laboratori centralizzati che devono frequentemente condurre ulteriori analisi di conferma o effettuare test al di fuori dei normali orari di lavoro. «Il nuovo test per la COVID-19, che espande la gamma di prodotti aziendali a 13 test, utilizza il formato di reagente molecolare brevettato di HiberGene per rilevare con accuratezza il virus nei tamponi nasali e faringei impiegando lo strumento HG Swift di HiberGene, un dispositivo portatile e di piccole dimensioni, per analizzare quattro campioni contemporaneamente», come riportato nel comunicato stampa dell’azienda. Citata nel medesimo comunicato stampa, Mariya Gabriel, commissaria europea per l’innovazione, la ricerca, la cultura, l’istruzione e i giovani, commenta: «È fondamentale diagnosticare il coronavirus più velocemente e in modo più accurato, poiché in questo modo si riduce il rischio di un’ulteriore diffusione del virus». Il progetto HG nCoV19 test (Development and validation of rapid molecular diagnostic test for nCoV19) è attualmente in corso e la sua conclusione è prevista per agosto 2021. Per ulteriori informazioni, consultare: progetto HG nCoV19 test
Parole chiave
HG nCoV19 test, coronavirus, COVID-19, diagnosi, salute