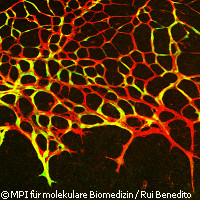
Forscher entdecken molekularen Schalter für Wachstum von Blutgefäßen
Europäische Forscher entdeckten, dass das Gefäßwachstum wie mit einem Schalter ein- und ausgeschaltet werden kann. Die im Fachblatt Cell veröffentlichten Ergebnisse könnten neue therapeutische Möglichkeiten bei Krankheiten eröffnen, die durch mangelnde oder übermäßige Gefäßneubildung entstehen. Neue Blutgefäße werden besonders in Entwicklungs-, Wachstums- und Wundheilungsphasen ausgebildet. Dabei kann dieses verzweigte Netzwerk bei Bedarf erweitert werden, um alle Gewebe kontinuierlich mit Sauerstoff und Nährstoffen zu versorgen. Kommt es zu Fehlern bei der Gefäßneubildung, also werden zu wenige oder zu viele Gefäße gebildet, kann dies schwere Gesundheitsschäden hervorrufen. Beispielsweise können Herzinfarkte auftreten, wenn die Blutzufuhr zum Herzen blockiert wird. Die Forscher suchen nun nach Möglichkeiten, die Gefäßneubildung im Herzen zu stimulieren. Tumore wiederum sind auf eine ausgedehnte Blutversorgung über neue Gefäße angewiesen, deren Blockierung den Krebs quasi aushungern könnte. Mit dem Verzweigungsmechanismus bei Blutgefäßen beschäftigt sich die Wissenschaft schon seit geraumer Zeit. In ihrer jüngsten Studie entdeckten Forscher aus Deutschland und dem Vereinigten Königreich einen molekularen Schalter, der das Verhalten einzelner Zellen steuert. Dieser "Schalter" ist ein Rezeptor mit dem Namen Notch, der auf der Oberfläche der Blutgefäßzellen sitzt, die die Adern auskleiden. An diesen Notch-Rezeptor binden verschiedene Proteine, die dafür sorgen, dass er ein- oder ausgeschaltet wird. Ist Notch eingeschaltet, werden die Zellen für den Wachstumsfaktor VEGF (Vascular Endothelial Growth Factor) empfänglich und induzieren, wie der Name bereits andeutet, das Wachstum neuer Adern. In ihrer neuen Studie entdeckten die Forscher, dass das Protein Jagged1 den Notch-Rezeptor einschaltet und sich neue Blutgefäße bilden. Es handelt sich dabei ebenfalls um ein Oberflächenprotein, das auf der Außenseite der Zellen sitzt und dadurch in Kontakt zu Notch-Rezeptoren benachbarter Zellen treten kann. "Wir haben jetzt erstmals verstanden, wie diese einzelnen Komponenten zusammen wirken", erklärt Professor Dr. Ralf H. Adams vom Max-Planck-Institut für molekulare Biomedizin in Deutschland. "In anstehenden Versuchen an Mäusen wollen wir lernen, das Gefäßwachstum aktiv zu steuern", und zwar so, wie es in Zukunft einmal Medikamente beim Menschen leisten könnten, wie er hinzufügte. Die Hemmung des Wachstumsfaktors VEGF wird bereits seit einigen Jahren bei der Behandlung von Krebspatienten und bestimmten Augenerkrankungen eingesetzt. Leider sind solche Therapien sehr teuer und wegen starker Nebenwirkungen für viele Patienten ungeeignet. "Mit der Aufklärung der Funktion von Jagged1 hoffen wir, nun eine echte Alternative für zukünftige Therapieansätze gefunden zu haben", ergänzt Dr. Rui Benedito, der ebenfalls am Max-Planck-Institut für molekulare Biomedizin forscht. Als nächster Schritt folgt die gründliche Überprüfung der Wirksamkeit dieses Therapieansatzes und der gesundheitlichen Folgen, die eine Ausschaltung von Notch haben kann, denn Notch spielt auch bei der Entwicklung des Nerven- und Immunsystems eine entscheidende Rolle. "Notch, Dll4 [ein Protein, das die Gefäßneubildung hemmt] und Jagged1 haben auch in anderen Organen und Zelltypen wichtige Aufgaben", erläutern Professor Adams und Dr. Benedito. "Das macht eine Beschränkung der Wirkung [von Medikamenten] auf Blutgefäßzellen anspruchsvoll. Wir hoffen dennoch, dass unsere Arbeit zur Entwicklung neuer Medikamente führen wird."
Länder
Deutschland, Vereinigtes Königreich