Entwicklung von Antibiotika neu gedacht
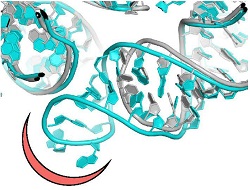
Die meisten klinisch wirksamen Antibiotika sind natürliche Verbindungen, die Mikroorganismen zum Schutz vor Krankheitserregern produzieren. Um deren Wirkungskraft zu erhöhen, modifizieren Pharmahersteller die natürlichen Antibiotika chemisch oder erzeugen semisynthetische Nachbildungen. Krankheitserregende Bakterien wie Staphylococcus aureus reagieren auf den Druck von natürlichen und verbesserten Antibiotika mit Resistenz, was die Wirksamkeit der Antibiotika signifikant einschränkt. Interessant ist, dass antimikrobielle Resistenz für viele Mikroorganismen eine der wichtigsten Überlebensstrategien ist und Gene für Antibiotikaresistenz schon existierten bevor natürliche Antibiotika in der Medizin eingesetzt wurden. Diese Resistenz äußert sich in verschiedenen Mechanismen auf Molekülebene, wie zum Beispiel bei der Aktivierung von Effluxpumpen, die die Wirkstoffe ausspülen, oder Mutationen, die die Bindungstaschen der Antibiotika verändern. Wissenschaftler des EU-finanzierten Projekts NOVRIB konzentrierten ihre Forschungsarbeiten auf Antibiotika, die Ribosomen –also Komplexe aus Proteinen und RNS, die für die Biosynthese von Proteinen zuständig sind – angreifen. Mit ihrer lebenswichtigen Funktion stellen Ribosomen für viele Antibiotika ein Angriffsziel dar, die ja im Wesentlichen die Proteinsynthese in pathogenen Mikroorganismen verhindern. Professor Ada Yonath, Trägerin des Nobelpreises für Chemie und Projektkoordinatorin, fasst zusammen: „NOVRIB hat neue, wirkungsvolle selektive Präparate untersucht und dabei nicht nur versucht, die Antibiotikaresistenz zu bekämpfen oder zu verringern, sondern auch das Mikrobiom und die Umwelt zu schützen.“ Auf dem Weg zu ribosomalen Antibiotika Momentan konzentriert sich die Antibiotikaforschung hauptsächlich auf wenig erforschte Nischen der mikrobiellen Welt oder die Gestaltung neuer chemischer Sonden zur Wirkungssteigerung bestehender Antibiotika. Die Forscher von NOVRIB hatten einen anderen Ansatz: sie weiteten die allgemeine Suche nach bisher unbekannten Mechanismen in Wirkungsweise, Selektivität und Resistenz von Antibiotika aus, indem sie neue Bindungsstellen der Antibiotika entdeckten. Diese Stellen zeigten großes Potenzial als nützliche Angriffsziele, da Resistenzen dort nicht innerhalb kurzer Zeit zu erwarten sind. Dazu wurde per Kristallstrukturanalyse und der erst vor Kurzem entwickelten 3D-Elektronenmikroskopie die exakte Struktur der Ribosomen im pathogenen Bakterium Staphylococcus aureus bestimmt. Aus einem Vergleich dieser Struktur mit der von Ribosomen aus nicht pathogenen Bakterien ergaben sich einzigartige Strukturmotive, die für die Entwicklung neuer pathogenspezifischer Medikamente als Ansatzpunkt genutzt werden können. „Mit diesen Erkenntnissen konnten wir neue selektive Antibiotika entwickeln, die weniger Resistenz verursachen und so dem aktuellen Problem steigender Resistenzen entgegenwirken“, so Professor Yonath weiter. Die Zukunft der Antibiotika Durch das Auftauchen multiresistenter Erreger in Kombination mit der äußerst geringen Zahl neuer Antibiotika, die momentan von Pharmaunternehmen erforscht werden, droht uns ein Rückfall in die Zeit als es noch keine Antibiotika gab und Infektionen nicht behandelt werden konnten. Professor Yonath blickt optimistisch in die Zukunft, betont aber „die akute Notwendigkeit neuer antibakterieller Wirkstoffe“. Die toxische Wirkung von Antibiotika sowie die weitere Verbreitung von Medikamentenresistenzen stehen in engem Zusammenhang mit der chemischen Zusammensetzung vieler bestehender Antibiotika, die nicht biologisch abbaubar sind und von Menschen oder Tieren nicht verdaut werden können. Sie kontaminieren die Umwelt und können in landwirtschaftliche Bewässerungsanlagen eindringen, was direkte Auswirkungen auf die Gesundheit des Menschen und der Tiere hat. Die neuen Bindungsstellen der Antibiotika, die in dieser Untersuchung entdeckt wurden, könnten auch dieses Problem lösen, da je nach Bedarf Verbindungen hergestellt werden können, die artenspezifisch und nur minimal toxisch sind. Dadurch reduziert sich die weit verbreitete Antibiotikaresistenz, während gleichzeitig das Mikrobiom auf umweltfreundliche Weise erhalten wird. Kurz gesagt bietet der Ansatz der Strukturanalyse, der in NOVRIB entwickelt wurde, im Gegensatz zum aktuell bevorzugten Einsatz von Breitbandantibiotika in der Medizin Möglichkeiten, pathogenspezifische Antibiotika zu entwickeln, die selektiv, biologisch abbaubar und kaum toxisch sind. „Umweltfreundliche Medikamente sollten auch dabei helfen, Antibiotikaresistenzen zu reduzieren“, fasst Professor Yonath zusammen.
Schlüsselbegriffe
NOVRIB, Antibiotika, Resistenz, Ribosom, Bakterien