Un regard neuf sur la conception des antibiotiques
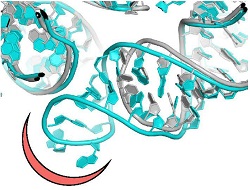
La plupart des antibiotiques utiles utilisés à des fins cliniques sont des composés naturels produits par des micro-organismes comme moyen de défense contre des agents pathogènes. Pour améliorer leur pouvoir, les sociétés pharmaceutiques modifient chimiquement les antibiotiques naturels ou génèrent des analogues semi-synthétiques. Toutefois, les bactéries pathogènes, comme la Staphylococcus aureus, répondent à la pression imposée par les antibiotiques naturels et améliorés, en développant une résistance, ce qui entrave considérablement leur efficacité. Étonnamment, la résistance antimicrobienne est une tactique essentielle de survie pour de nombreux micro-organismes, et les gènes de résistance aux antibiotiques existaient avant l’utilisation clinique des antibiotiques naturels. La résistance se manifeste par différents mécanismes moléculaires, comme l’activation de pompes d’efflux de médicaments ou des mutations qui modifient les poches de liaison de l’antibiotique. Les scientifiques du projet NOVRIB financé par l’UE ont centré leur recherche sur les antibiotiques qui ciblent les ribosomes, ces complexes de plusieurs protéines et d’ARN qui stimulent la biosynthèse des protéines. En raison de leur rôle déterminant dans la vie, les ribosomes constituent une cible pour de nombreux antibiotiques, qui, en substance, empêchent la synthèse des protéines chez les micro-organismes pathogènes. Comme la lauréate du Nobel de chimie et coordinatrice du projet, la professeure Ada Yonath, le souligne: «NOVRIB a exploré de nouveaux composés puissants et sélectifs en gardant à l’esprit qu’il s’agissait non seulement de lutter contre la résistance aux antibiotiques ou de la réduire, mais aussi de préserver le microbiome et l’environnement». Faire progresser les antibiotiques ribosomiques Actuellement, la recherche sur les antibiotiques se concentre principalement sur les foyers microbiens sous-exploités ou sur la conception de nouvelles sondes chimiques pour améliorer la performance des antibiotiques existants. Le consortium de NOVRIB a proposé d’adopter une tout autre approche. Les chercheurs ont étendu la recherche courante pour établir des mécanismes encore inconnus de fonction antibiotique, la sélectivité et la résistance, en découvrant de nouveaux sites de liaison des antibiotiques. Ces sites ont démontré un grand potentiel pour devenir des cibles utiles, et la résistance devrait y être moindre prochainement. Pour atteindre cet objectif, les chercheurs ont déterminé la structure détaillée des ribosomes issus des bactéries pathogènes, Staphylococcus aureus, en procédant à une cristallographie aux rayons X ou à la microscopie électronique à balayage 3D récemment mise au point. En comparant cette structure à celles des ribosomes de bactéries non pathogènes, ils ont identifié des motifs structurels uniques qui fournissent de nouveaux sites pour la conception de nouveaux médicaments propres à un agent pathogène. «Cette découverte a posé les bases pour la conception de nouveaux antibiotiques sélectifs, moins susceptibles de développer une résistance, et permet ainsi d’aborder les graves problèmes actuels liés à la résistance», poursuit la professeure Yonath. L’avenir des antibiotiques L’émergence de souches multirésistantes, associée au très faible nombre de nouveaux antibiotiques actuellement développés par les sociétés pharmaceutiques menacent de nous renvoyer à l’ère préhistorique où les infections étaient incurables. En se tournant vers l’avenir, la professeure Yonath se montre optimiste mais insiste sur «le besoin urgent de développer de nouveaux agents antibactériens». La toxicité des antibiotiques – et la propagation de la résistance aux médicaments – est liée à la composition chimique de nombreux antibiotiques existants qui sont non-biodégradables et indigestes pour les humains ou les animaux. Par conséquent, ils contaminent l’environnement et peuvent pénétrer dans les systèmes d’irrigation agricole, ce qui a des conséquences directes pour la santé des hommes et des animaux. Les sites de liaison des nouveaux antibiotiques, qui ont été découverts au cours de cette étude, pourraient également résoudre ce problème, étant donné qu’ils peuvent être conçus selon des composés de préférence, avec une spécificité d’espèces et une toxicité minimale, réduisant ainsi la résistance aux antibiotiques généralisée tout en préservant le microbiome de manière écologique. En résumé, contrairement à la préférence médicale actuelle accordée aux antibiotiques à large spectre, l’approche par une analyse structurelle de NOVRIB fournit les moyens de concevoir des antibiotiques propres à un agent pathogène, sélectifs, biodégradables et faiblement toxiques. «Les médicaments écologiques devraient également contribuer à réduire la résistance aux antibiotiques», conclut la professeure Yonath.
Mots‑clés
NOVRIB, antibiotique, résistance, ribosome, bactéries