Reconsideración del diseño de los antibióticos
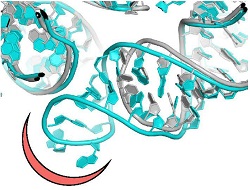
La mayoría de los antibióticos clínicamente útiles son compuestos naturales producidos por microorganismos como defensa contra los patógenos. Para mejorar su potencia, las empresas farmacéuticas modifican químicamente los antibióticos naturales o generan análogos semisintéticos. Sin embargo, las bacterias patógenas, como el «Staphylococcus aureus», responden a la presión impuesta por los antibióticos naturales y mejorados desarrollando una resistencia, con lo que dificultan considerablemente su eficacia. Curiosamente, la resistencia antimicrobiana es una táctica de supervivencia clave para muchos microorganismos y los genes de resistencia a los antibióticos ya existían antes del uso clínico de los antibióticos naturales. La resistencia se manifiesta a través de distintos mecanismos moleculares, como la activación de bombas eflujo de fármacos o mutaciones que modifican las hendiduras de unión con los antibióticos. Los científicos del proyecto financiado con fondos europeos NOVRIB centraron sus investigaciones en los antibióticos que tienen como diana los ribosomas, conjuntos de proteínas y ARN que inducen la biosíntesis de proteínas. Dado su papel clave en la vida, los ribosomas constituyen la diana de muchos antibióticos, que fundamentalmente inhiben la síntesis proteica en los microorganismos patógenos. Tal como destaca la ganadora del Nobel de Química y coordinadora del proyecto, la profesora Ada Yonath: «NOVRIB exploró nuevos compuestos selectivos potentes teniendo presente no solo la lucha contra la resistencia a los antibióticos o su reducción, sino también la conservación del microbioma y el medio ambiente». Antibióticos ribosómicos avanzados Actualmente, la investigación de antibióticos se concentra principalmente en nichos de microbios insuficientemente estudiados o en el diseño de nuevas sondas químicas para la mejora de los resultados de los antibióticos existentes. El consorcio NOVRIB propuso un enfoque distinto: ampliaron la búsqueda común para establecer mecanismos todavía desconocidos del funcionamiento de los antibióticos, la selectividad y la resistencia descubriendo nuevos sitios de unión de los antibióticos. Estos sitios demostraron un gran potencial para convertirse en dianas útiles para las cuales no se espera que surja pronto resistencia. Para lograr este objetivo, determinaron la estructura pormenorizada de los ribosomas de las bacterias patógenas el «Staphylococcus aureus» mediante la cristalografía de rayos X o la microscopía de electrones en 3D recientemente desarrollada. Al comparar esta estructura con la de los ribosomas de las bacterias no patógenas identificaron unidades estructurales únicas que proporcionan nuevos sitios para el diseño de nuevos fármacos específicos para determinados patógenos. «Esto allanó el camino para el diseño de nuevos antibióticos selectivos, menos susceptibles a la resistencia, con miras a hacer frente a los graves problemas actuales de resistencia», prosigue la profesora Yonath. El futuro de los antibióticos La aparición de cepas multirresistentes, junto con la escasez de antibióticos nuevos que están actualmente en los proyectos para descubrir medicamentos de las farmacéuticas, amenazan con hacernos volver a la época sin antibióticos en que las infecciones no podían tratarse. De cara al futuro, la profesora Yonath está esperanzada, pero recalca: «la necesidad inmediata de nuevos agentes antibacterianos». La toxicidad de los antibióticos —y la propagación de la farmacorresistencia— guarda relación con la composición química de muchos antibióticos existentes que no son biodegradables y que los humanos o animales no pueden digerir. Por consiguiente, estos contaminan el medio ambiente y pueden introducirse en los sistemas de riego agrícola, con implicaciones directas sobre la salud de los humanos y animales. Los nuevos sitios de unión de los antibióticos, que se descubrieron en este estudio, también podrían solucionar este problema, puesto que se pueden diseñar de acuerdo con compuestos preferentes, con especificidad de especie y una toxicidad mínima. De este modo, se reduce la resistencia generalizada a los antibióticos, a la vez que se conserva el microbioma de una forma respetuosa con el medio ambiente. En resumen, a diferencia de la preferencia médica actual por los antibióticos de amplio espectro, el enfoque de un análisis estructural de NOVRIB proporciona los medios para diseñar antibióticos específicos para un patógeno que presenten selectividad, biodegradabilidad y una toxicidad mínima. «Los fármacos respetuosos con el medio ambiente también deberían ayudar a reducir la resistencia a los antibióticos», concluye la profesora Yonath.
Palabras clave
NOVRIB, antibióticos, resistencia, ribosoma, bacterias