Präzisionsdiagnose und Behandlung für schwer behandelbare Krebsarten
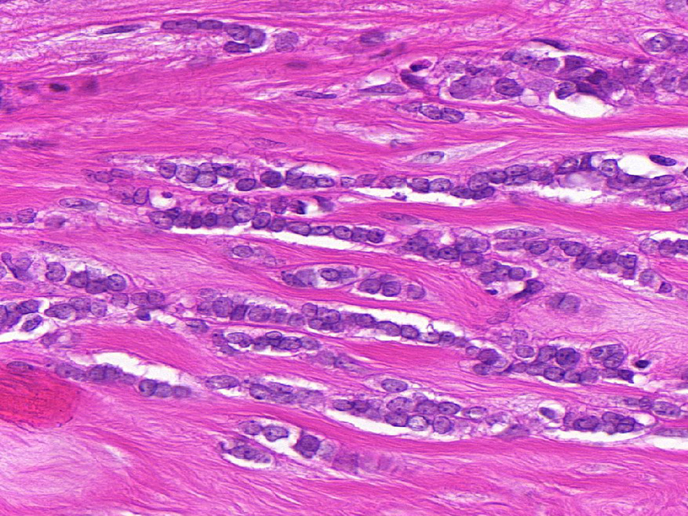
Die Krebs-Genotypisierung hat die Reaktionen auf zielgerichtete Medikamente in der Tumortherapie mit Mutationen spezifischer Gene korreliert. Viele dieser Mutationen treten in Signalisierungskomponenten auf, die als Kinasen bezeichnet werden. Bei schwer behandelbaren Subtypen von invasiven lobulären Karzinomen (invasive lobular carcinoma, ILC) oder triple-negativem (TN) Brustkrebs, die 25 % aller Brustkrebserkrankungen ausmachen, gibt es derzeit einen Mangel an zielgerichteten Therapien, der zu schlechten Patientenprognosen führt. Das EU-unterstützte Projekt RATHER (Rational Therapy for Breast Cancer: Individualized Treatment for Difficult-to-Treat Breast Cancer Subtypes) entwickelte spezifische Biomarkersignaturen für die genaue Ergebnisprognose von Patienten mit ILC (unter Verwendung des MammaPrint-Tests) oder für die Reaktion von Patienten mit TN-Brustkrebs auf Therapien (unter Verwendung des BRCAness-Tests). Außerdem wurden neue Behandlungen für beide Brustkrebs-Subtypen enthüllt. Die Ergebnisse von RATHER haben unmittelbares klinisches Potenzial, um die Reichweite von MammaPrint (ein bereits genehmigter Diagnose-Assay) in der Untergruppe von ILC-Brustkrebs zu erweitern. Das Projekt hat auch zu mehreren klinischen Studien beigetragen, und die Arbeit führt zu neuen Ansätzen für die Diagnose und Behandlung, die jetzt den Weg für Fortschritte im Brustkrebsmanagement ebnen. Maßgeschneiderte Arzneimittel Viele Krebserkrankungen verändern wichtige zelluläre Proteine, die als Kinasen bekannt sind. Abgesehen davon, dass sie eine wichtige Rolle bei physiologischen Signalpfaden spielen, fungieren Kinasen im Hinblick auf Krebserkrankungen auch als molekulare Schalter zur Steuerung des Wachstums und der Streuung. RATHER untersuchte die Gene, die Kinaseproteine produzieren, um zu bestimmen, ob spezifische Änderungen am Gencode oder sonstige Veränderungen in den Krebszellen von Patienten Aufschluss darüber geben könnten, warum sich der Krebs bildet und streut. RATHER erforschte die Aktivierungsrate aller Kinasen (das Kinom) bei TN-Brusttumoren, denen Östrogen-, Progesteron- und HER2-Rezeptoren fehlten (15 % der Brustkrebserkrankungen) und ILC der Brust (10 % der Brustkrebserkrankungen); genauer gesagt wurden 518 Kinasegene sequenziert, um Mutationen zu identifizieren, die mit einer der Brustkrebsarten assoziiert sind. Zusätzlich zu einer DNS-Sequenzierung wurden auch Kinaseveränderungen auf der mRNS- und Proteinebene sowie auf Beweise für eine Kopienzahlvariation untersucht. Veränderungen wurden unter Verwendung computergestützter Systeme und präklinischer Labormodelle erforscht. Projektkoordinator Prof. William Gallagher erklärt: „Unsere Arbeit identifizierte Unterschiede in verschiedenen Brustkrebs-Subtypen und gründet auf der Tatsache, dass manche dieser Veränderungen am Fortschreiten der Erkrankung beteiligt und nicht nur Zufallseffekte sind.“ Auf Grundlage ihrer Fähigkeit, das Wachstum von Zellen einzuschränken, die subtypenspezifische Kinaseveränderungen exprimieren, wurden soweit möglich niedermolekulare Inhibitoren ausgewählt. Das RATHER-Konsortium nahm in einer multizentrischen Phase-Ib/II-Studie für ein neues Kinaseinhibitor-Medikament namens „Taselisib“ eine führende Stellung ein. Die anfängliche Phase-Ib-Studie zeigte erfolgreich, dass eine Kombination aus traditioneller endokriner Therapie (das Medikament Tamoxifen) und dieses neuen Kinaseinhibitors für die Patienten gut verträglich war. Prof. Gallagher erklärt zusammenfassend: „Durch die Enthüllung von Veränderungen an bestimmten Kinasen sowie der Funktion des mutierten Proteins und die anschließende Zurückverfolgung auf den spezifischen Brustkrebssubtyp des Patienten entdeckten wir mehrere neue Wege für die genaue Prognose der Patientenergebnisse und potenziell auch für die effektivere Behandlung von Patienten mit diesem Subtyp.“ RATHER leistet einen direkten Beitrag für Anwendungen, die nicht nur eine bessere Diagnostik, sondern auch therapeutische Optionen für Brustkrebs, eine der Hauptursachen für krebsbedingte Todesfälle bei Frauen, ermöglichen werden. Die Arbeit von RATHER ist auf weiter gefasste Maßnahmen für eine individuelle Krebsbehandlung abgestimmt. Die Phase-II-Studie zu dem neuen Kinaseinhibitor wird derzeit neben komplementären Studien durchgeführt.
Schlüsselbegriffe
RATHER, Brustkrebs, Mutation, Protein, Kinase, invasives lobuläres Karzinom, Biomarker, Diagnostik, molekular, Gen, Sequenzierung