Markierung von Proteinmolekülen für die Lieferung an Zellmembran
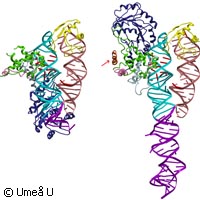
In einer neuen Studie, die in der Fachzeitschrift Nature Structural and Molecular Biology veröffentlicht wurde, zeigen Forscher der Universität Umeå in Schweden, wie eine Zelle die korrekte Verteilung der Proteine in ihrem Inneren sicherstellt. Sie erstellten ein genaues Bild von Proteinen, die mit einer Art Markierung ausgestattet sind, anhand derer die Proteine durch die Zellmembran geleitet werden. Die meisten Organismen mit einer komplexen Struktur bestehen aus unzähligen Zellen, die wiederum Unmengen komplexer Formen enthalten. Die Zellen erzielen eine derart ausgeklügelte Organisation größtenteils dadurch, dass sie sicherstellen, dass ihre verschiedenen Proteine an der richtigen Stelle ankommen. Wie sie dieses Kunststück fertig bringen, ist für die Forscher von großem Interesse. Wenn wir wissen, wie Zellen festlegen, welches Protein in eine Zelle hineingehört, und welche exportiert werden, sind wir in der Lage, das System zu unserem Vorteil umzugestalten. Der Mechanismus, mit dem bestimmte Proteingruppen an ihren richtigen Platz in der Zelle geleitet werden, ist auch weiterhin eine der faszinierendsten Fragen der Biologie. Selbst der erste Schritt ist bisher unklar: der offensichtlich seltsame Transport großer Polypeptide durch die Membran des endoplasmatischen Retikulums. Dennoch kennen die Wissenschaftler einige der Grundprinzipien des Prozesses: Ein wesentlicher Einblick, den kürzlich Wissenschaftler in Umeå gewonnen haben, erklärt, wie Proteine vollständig aus der Zelle exportiert werden. Der erste Schritt des Exportmechanismus beruht auf einem Molekülkomplex. Dieser besteht aus einem kleinen RNA-Molekül, das mit fünf spezifischen Polypeptiden ineinander verschlungen ist. Zusammen bilden sie ein Signalerkennungspartikel (SRP). Dieser Komplex sucht die für den Export bestimmten Proteine aus und verbindet sich mit ihnen. Wie das SRP wurde auch ein weiteres Prinzip, das hauptsächlich in der gleichen Form in allen Zellen vorkommt, entdeckt: die "Adressenmarkierung". Die Zellen scheinen kurze Aminosäuresequenzen, aus denen ein Protein besteht, als Markierung für das Endziel des Proteins zu verwenden. Ohne diese Signalsequenz kann ein Protein nicht mit dem SRP interagieren und das endoplasmatische Retikulum durchqueren. Dieses besondere Signal wird während der Membrandurchquerung entfernt und ein anderes Signal kommt ins Spiel. Andere Aminosäuresequenzen können auch als Signal für weitere Sortierungsschritte dienen. Dieser Forschungsbereich ist besonders faszinierend. Eine dieser zusätzlichen Peptid-Markierungen kennen die Forscher bereits. Hierbei handelt es sich um Ankersequenzen. Die Ankersequenzen befinden sich häufig am Ende der Proteine. Sie bestehen aus hydrophoben Aminosäuren und fixieren Proteine fest an den Membranen. Eigenartigerweise funktionieren einige Ankersequenzen nur an ihrer Endstation, d.h. außerhalb der Membran des endoplasmatischen Retikulums oder einer anderen Membran im Exportweg. Diese komplexen Mechanismen sind in allen tierischen und pflanzlichen Zellen am Werk, aber der Methanococcus Jannaschii - ein autotrophischer hyperthermophiler Organismus, der zu den Archaeen gehört - ist viel einfacher. Dieser Einzeller bot den Wissenschaftlern in Umeå ein unkompliziertes Modell, an dem sie die SRP-Struktur mit und ohne Leitsignalsequenz untersuchen konnten. Sie setzten hierfür die sogenannte Röntgenkristallografie ein. "Die strukturellen Veränderungen waren viel größer als bisher angenommen", erklärt Elisabeth Sauer-Eriksson, Professorin im Fachbereich Chemie an der Universität Umeå. "Sie liefern uns umfassende Erklärungen über die Rolle, die SRPs beim Proteintransport spielen. Diese strukturellen Spezifikationen können auch als Modell für die Funktion der SRPs auf verschiedenen Ebenen während des Proteintransports dienen." Wenn erst einmal die faszinierenden Mechanismen aufgeklärt sind, mit denen Zellen ihre Proteine für den Export kennzeichnen und sortieren, können Gentechniker Mikroorganismen dazu bringen, beliebige Proteine zu exportieren. Die Studie wurde vom schwedischen Forschungsrat, dem Umeå Centre of Microbial Research und der Kempe Foundation finanziert.Weitere Informationen unter: Umeå University http://www.umu.se/english/ Nature Structural and Molecular Biology http://www.nature.com/nsmb/index.html