Proteinverteilung funktioniert nach einfachen Regeln
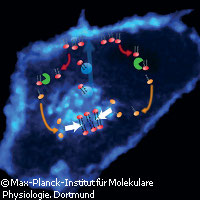
Von der EU finanzierte Wissenschaftler haben die einfachen Regeln entdeckt, nach denen die korrekte Verteilung von Proteinen innerhalb von Zellen sichergestellt wird. Zudem konnten sie demonstrieren, wie ihre Entdeckung möglicherweise zu neuen Wegen in der Krebstherapie führen könnte. Die Forschungsarbeit, beschrieben in zwei Artikeln in den Zeitschriften Cell und Nature, erhielt EU-Finanzhilfen aus einem Marie-Curie-Stipendium. Ohne ein System, das ihre Verteilung regelt, würden Proteine dazu neigen, sich gleichmäßig in der Zelle zu verteilen. Wie also stellen Zelle sicher, dass Proteine dahin gelangen, wo sie gebraucht werden? Eine Gruppe von Forschern unter der Leitung von Herbert Waldmann und Philippe Bastiaens vom Max-Planck-Institut für molekulare Physiologie (MPI) in Deutschland konnte mittels modernster Mikroskopieverfahren den Transport von Proteinen in lebenden Zellen und in Echtzeit verfolgen. Die Forscher konzentrierten ihre Bemühungen auf Proteine, die an der äußeren Zellmembran gebraucht werden. Diese Proteine werden mit einem Fettsäure-Molekül versehen. Durch diese so genannte Palmitoylierung erhalten die Membranproteine eine Art Adressaufkleber. Wie die Studie nun entdeckte, findet die Palmitoylierung in einem Teil der Zelle statt, der als Golgi-Apparat bezeichnet wird. Die palmitoylierten Proteine werden auf der Oberfläche winziger Bläschen zur Zellmembran transportiert, die vom Golgi-Apparat abgeschnürt werden. Innerhalb der Zelle befinden sich aber viele verschiedene Arten von Membranen und manchmal erreichen die palmitoylierten Proteine nicht das richtige Ziel, sondern hängen sich an falsche Membrane an. Damit das nicht passiert, entfernen spezielle Enzyme in einem "Depalmitoylierung" genannten Prozess den Fettsäureanker von dem Protein, das dann frei in der Zelle schwimmt. Irgendwann wird das Protein wieder in den Golgi-Apparat aufgenommen und der Zyklus beginnt von vorne. Die Frage lautet dann: Wie erkennt der Golgi-Apparat die Proteine, die zur Zellmembran gelangen sollen? Die Antwort ist überraschend einfach. Grundlegend bestehen Proteine aus Aminosäureketten. Wenn die Aminosäure Cystein leicht zugänglich an der Oberfläche des Proteins liegt, erhält es einen Adressaufkleber in Form eines Fettsäureankers. "Diese Ergebnisse sind ein Meilenstein. Sie werden die Art verändern, wie künftig in der Zellbiologie geforscht wird", kommentiert Professor Bastiaens. "Denn nur wenn wir die Prinzipien kennen, nach denen das Leben funktioniert, werden wir es wirklich verstehen können. Die Fokussierung auf die vielen verschiedenen Signalwege innerhalb der Zelle helfen uns da nicht viel weiter." Darüber hinaus hat die Forschergruppe bereits demonstriert, wir ihre Erkenntnisse bei der Suche nach neuen Behandlungsmethoden für Krebs angewandt werden können. Das Signalmolekül Ras ist ein palmitoyliertes Protein, das durch Mutierung zu Krebs führen kann. Es funktioniert allerdings nur dann, wenn es in der Zellmembran verankert ist. Wird Ras komplett abgeschaltet, sterben selbst gesunde Zellen ab. Daher wählten die Forscher einen anderen Ansatz. Wie oben erläutert, werden alle palmitoylierten Proteine manchmal an die falschen Membrane verankert, Ras nicht ausgenommen. Wenn Ras sich falsch anheftet, entfernt ein Enzym mit dem Namen APT1 (Acyl Protein Thioesterase 1) den Fettanker, sodass Ras wieder zurück ins Transportsystem aufgenommen werden kann. Die Forscher erschufen den neuen Hemmstoff Palmostatin B, der die Aktivitäten von APT1 blockiert. Dadurch bleibt Ras tatsächlich stecken, wenn es sich zu einer falschen Membran verirrt hat. Mit der Zeit wird Ras wahllos über die unterschiedlichen Membrane in der Zelle verteilt. Da Ras nur wirklich schädlich ist, wenn es an der äußeren Zellmembran verankert ist, werden durch die wahllose Verteilung der Proteine die Ras-Signale unterdrückt und aus Krebszellen werden wieder gesunde Zellen. "Dies war ein völlig neuer Ansatz, der eigentlich dem gesunden Menschenverstand widerspricht. Deswegen hat ihn auch die Pharmaforschung nie weiter verfolgt", erklärte Professor Waldmann. Er und sein Team gingen folgendermaßen vor: "Wir haben nicht den gerichteten Transport aus dem Golgi-Apparat gehemmt, sondern die wahllose Verteilung in der Zelle gefördert."
Länder
Deutschland