Molecole proteiche "etichettate" per la distribuzione alla membrana cellulare
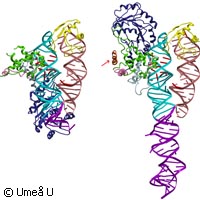
In un nuovo studio pubblicato sulla rivista Nature Structural and Molecular Biology, ricercatori dell'Università di Umeå, in Svezia, mostrano come la cellula garantisce la corretta distribuzione di proteine al suo interno, fornendo un quadro dettagliato delle proteine distribuite con una sorta di etichetta che serve a guidare le proteine attraverso la membrana cellulare. La maggior parte degli organismi con una struttura complessa è composta di innumerevoli cellule, che a loro volta sono anch'esse ricche di forme complesse. Le cellule riescono a raggiungere un livello di organizzazione così sofisticato, in larga misura perché sono in grado di fare in modo che le loro varie proteine finiscano nel posto giusto. Come ci riescano è oggetto di grande interesse per gli scienziati. Se riuscissimo a capire come fanno le cellule a stabilire quale proteina deve andare e dove, all'interno della cellula, e quali devono essere esportate, potremmo essere in grado di riprogettare il sistema a nostro vantaggio. Eppure, il meccanismo in base al quale diverse famiglie di proteine sono inviate nel luogo appropriato all'interno della cellula resta una delle domande irrisolte più affascinanti della biologia. È un mistero persino la prima fase: il processo apparentemente bizzarro per cui grandi polipeptidi attraversano l'interno denso e impermeabile della membrana del reticolo endoplasmatico. Ciononostante gli scienziati sono in grado di riconoscere alcune delle dinamiche di base del processo e una delle scoperte più importanti, fatta di recente dai ricercatori dell'Università di Umeå, spiega come sono esportate le proteine, anche nella loro totalità, dalla cellula. La prima fase del meccanismo di esportazione si basa su un complesso molecolare composto di una piccola molecola di acido ribonucleico (RNA) intrecciata con cinque polipeptidi specifici. Insieme costituiscono una particella di riconoscimento del segnale (SRP). Questo complesso ricerca e si combina con le proteine destinate all'esportazione. È stato scoperto anche un altro principio, individuato essenzialmente nella stessa forma in tutte le cellule, come gli SRP: L'"etichetta dell'indirizzo". Le cellule sembrano usare brevi sequenze di amminoacidi che compongono una proteina come etichette per la destinazione finale della proteina. Senza questa sequenza di segnalazione, una proteina non è in grado di interagire con l'SRP e di spostarsi all'interno del reticolo endoplasmatico. Questo specifico segnale è rimosso durante lo spostamento nella membrana, lasciando spazio all'intervento di un altro segnale. Anche altre sequenze di amminoacidi possono fungere da segnali durante ulteriori fasi dello smistamento. È un campo di ricerca molto entusiasmante. Una di queste etichette aggiuntive di peptidi è già nota agli scienziati: la sequenza di ancoraggio, che spesso si trova all'estremità di una proteina. Composte di amminoacidi idrofobici, la funzione delle sequenze di ancoraggio è fissare saldamente le proteine alle membrane. Stranamente alcune sequenze di ancoraggio funzionano solo nella loro posizione finale che è all'esterno della membrana del reticolo endoplasmatico o di qualsiasi altra membrana lungo il percorso di esportazione. Questi complessi meccanismi sono all'opera in tutte le cellule animali e vegetali, ma il methanococcus jannaschii (un organismo autotropico ipertermofilo che appartiene al regno degli Archaea) è molto più semplice. Questo microorganismo unicellulare ha offerto agli scienziati dell'Umeå un sistema campione più semplice per studiare la struttura degli SRP con e senza sequenza di segnalazione guida. La tecnologia usata è chiamata cristallografia a raggi X. "Le differenze strutturali erano considerevolmente maggiori di quanto previsto all'inizio", spiega Elisabeth Sauer-Eriksson, professore nel dipartimento di Chimica dell'Università di Umeå. "Ci offrono spiegazioni dettagliate sul ruolo svolto dagli SRP nel trasporto delle proteine. Queste specifiche strutturali possono anche fungere da modello sul modo in cui gli SRP funzionano a vari livelli durante il trasporto delle proteine". Se fosse svelato l'ingegnoso meccanismo attraverso il quale le cellule etichettano e smistano le loro proteine per l'esportazione, gli ingegneri genetici potrebbero fare in modo che i microorganismi secernano praticamente qualsiasi proteina. Lo studio è stato finanziato dal Consiglio di ricerca svedese, dal Centro di ricerca microbica di Umeå e dalla Fondazione Kempe.Per maggiori informazioni, visitare: Università di Umeå http://www.umu.se/english/ Nature Structural and Molecular Biology http://www.nature.com/nsmb/index.html