Einfachere, kindgerechte Verabreichung von Krebsmedikamenten
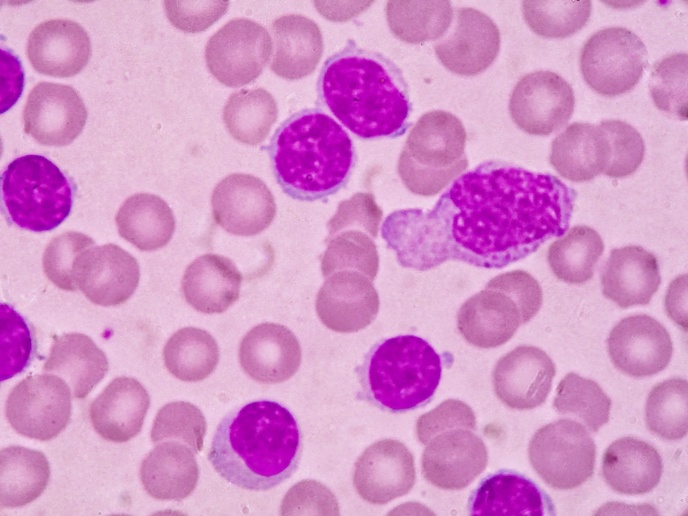
Obwohl diese Leukämieform fast ausschließlich bei Kindern vorkommt, wurde noch keine Wirkstoffformulierung speziell an kindliche Bedürfnisse angepasst. Der Wirkstoff wurde Kindern bislang in Tablettenform verabreicht, die eigentlich für Erwachsene konzipiert ist. Hauptziel des EU-finanzierten Projekts LOULLA&PHILLA war daher eine kombinierte Darreichung der beiden Wirkstoffe 6-Mercaptopurin (6MP) und Methotrexat (MTX) für die Erhaltungstherapie bei Leukämie. Im Vordergrund stand dabei auch eine besser auf kindliche Bedürfnisse abgestimmte Darreichungsform. Das Konzept beruht auf der Trennung von aromatisiertem Saft und aktiver Substanz. Zur Verabreichung müssen die Eltern lediglich die Kappe eindrücken, damit der Wirkstoff in den Saft fällt, und dann die Flasche schütteln. Die neue Darreichungsform mit aktiver Substanz in der Kappe und aromatisiertem Saft in der Flasche wurde bereits patentiert. Der nächste Schritt war die pharmazeutische Entwicklung, dann wurde die Stabilität der einzelnen Komponenten und die Genauigkeit der Dosierungsspritze demonstriert. In präklinischen Tests werden derzeit Geschmack und potenzielle Toxizität geprüften. Zufriedenstellende Resultate ergaben sich bei Sicherheit, Verträglichkeit, Pharmakokinetik und Geschmack, was insgesamt die Eignung der neuen, kindgerechten Suspension bestätigt. Obwohl die Bioverfügbarkeit der oralen Darreichung etwa ein Drittel schlechter ist als bei der Standardverabreichung, wird dies die klinische Wirkung beim einzelnen Patienten nicht beeinträchtigen, da die Dosis auf Basis von pharmakodynamischen und/oder Toxizitätsmarkern patientenspezifisch angepasst wird. Auf diese Weise erhält jeder Patient die für ihn geeignete Dosierung. Nach Validierung des Registrierungsdossiers wird die neue Formulierung derzeit von der Europäischen Arzneimittelagentur EMA geprüft. Da die Prüfung des Dossiers für die Marktzulassung etwa ein Jahr dauert, trifft der Projektkoordinator nun Vorkehrungen für die Vermarktung der neuen Formulierung. Neben der neuen Darreichungsform entwickelte das Projekt mit dem so genannten Shaker eine neue patentierte Verpackungstechnologie, was langfristig die Entwicklung kindgerechter Darreichungsformen und Produkte deutlich verbessern wird.