Łatwiejsza i wygodniejsza metoda leczenia raka u dzieci
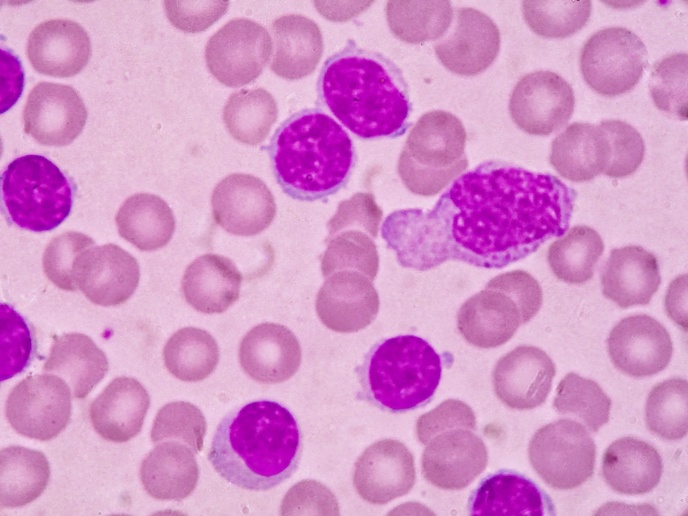
Pomimo że ta odmiana białaczki dotyka niemal wyłącznie dzieci, nie opracowano jak dotąd żadnego preparatu przeznaczonego do stosowania u tych pacjentów. Oznacza to, że do chwili obecnej dzieci musiały przyjmować tabletki przeznaczone dla dorosłych. Głównym celem finansowanego ze środków UE projektu LOULLA&PHILLA było połączenie dwóch leków, 6-merkaptopuryny (6MP) and methotrexatu (MTX) do stosowania w leczeniu podtrzymującym przeciwko rakowi. Naukowcy biorący udział w projekcie chcieli również znaleźć sposób podawania leku wygodniejszy dla młodych pacjentów. Członkowie projektu zadecydowali, że należy oddzielić aromatyzowany płyn od aktywnego składnika leku. Rodzice musieliby po prostu nacisnąć nakrętkę, aby aktywny składnik przedostał się do płynu, a następnie potrząsnąć buteleczką. Następnie opracowano i opatentowano nowe opakowanie z aktywnym składnikiem znajdującym się w nakrętce i aromatyzowanym płynem znajdującym się w buteleczce. Na kolejnym etapie opracowania farmaceutycznego udowodniono stabilność różnych składników oraz precyzję strzykawki dozującej. Uruchomiono wówczas testy przedkliniczne w celu oceny kwestii smakowych oraz potencjalnej toksyczności. Wszystkie dane dotyczące bezpieczeństwa i tolerancji, wyników farmakokinetycznych oraz walorów smakowych przemawiają za zastosowaniem tej nowej doustnej zawiesiny dla dzieci. Pomimo względnej biodostępności doustnej zawiesiny, średnio o jedną trzecią niższej niż standardowego leku, zakłada się, że nie będzie to miało żadnego wpływu na wyniki u poszczególnych pacjentów. Zostanie to zrównoważone na poziomie indywidualnym poprzez dostosowanie dawki z zastosowaniem markerów farmakodynamicznych i/lub toksyczności, zapewniając podanie każdemu pacjentowi odpowiedniej, adekwatnej dawki. Po przeprowadzeniu walidacji dokumentacji rejestracyjnej Europejska Agencja Leków (EMA) dokonuje aktualnie przeglądu nowych preparatów. Ponieważ proces przeglądu dokumentacji w celu wydania zezwolenia na dopuszczenie do obrotu trwa około roku, koordynator projektu przygotowuje się obecnie do dystrybucji tego nowego preparatu. Oprócz nowego systemu podawania, w ramach projektu opracowano z powodzeniem nową opatentowaną technologię pakowania o nazwie "mikser". Zakłada się, że te pozytywne postępy wywrą poważny, długoterminowy wpływ na tworzenie i opracowywanie leków dla dzieci.