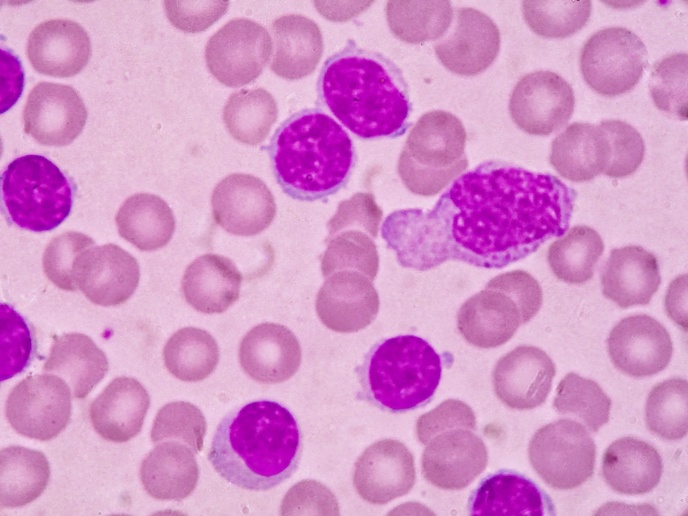
Une chimiothérapie plus facile et plus pratique pour les enfants
Bien que cette leucémie n''affecte presque exclusivement que les enfants, aucune formulation adaptée n''avait pour l''instant été développée. Ainsi, jusqu''à ce jour, les enfants devaient consommer des comprimés conçus pour les adultes. L''objectif principal du projet LOULLA&PHILLA financé par l''UE était d''associer les deux molécules utilisées dans le traitement d''entretien de ce cancer, la 6-mercaptopurine (6-MP) et le méthotrexate (MTX). Les chercheurs voulaient également développer une méthode d''administration plus pratique pour les jeunes patients. Les partenaires du projet ont décidé que la solution aromatisée devait être séparée de l''ingrédient actif. Les parents n''auraient plus qu''à presser le bouchon pour que l''ingrédient actif tombe dans la solution aromatisée puis à secouer pour homogénéiser. Ce nouveau conditionnement contenant l''ingrédient actif dans le bouchon et la solution aromatisée dans le flacon proprement dit a donc été développé et breveté. L''étape suivante demandait un développement pharmaceutique avec démonstration de la stabilité des divers composants et de la précision de la seringue orale de dosage. Des essais précliniques ont été initiés pour évaluer certaines questions comme la sapidité et la toxicité potentielle de cette nouvelle formulation. Toutes les données d''innocuité, de tolérance, de pharmacocinétique et de sapidité confortent l''utilisation de cette suspension orale pour les enfants. Malgré sa biodisponibilité relativement élevée, en moyenne 30% plus rapide que le traitement standard, les chercheurs n''attendent pas de différence clinique significative pour les patients. Cette biodisponibilité sera compensée individuellement par des ajustements de la posologie en fonction de marqueurs pharmacodynamiques et/ou de toxicité afin que chaque patient obtienne la dose qui lui convienne. Après validation du dossier d''enregistrement, l''Agence européenne des médicaments (AEM) examine maintenant les nouvelles formulations. Ce processus d''autorisation de mise sur le marché (AMM) demandant environ un an, le coordinateur du projet prépare actuellement la distribution de la nouvelle formulation. En plus du développement de cette nouvelle voie d''administration, les partenaires ont également développé et breveté une nouvelle technologie de conditionnement qu''ils ont appelé «le shaker». Les chercheurs espèrent que ces innovations auront un impact important sur la formulation et le développement d''autres traitements spécifiquement pédiatriques.