Zum überraschend komplexen Prozess des Einlagerns und Verlierens von Körperfett
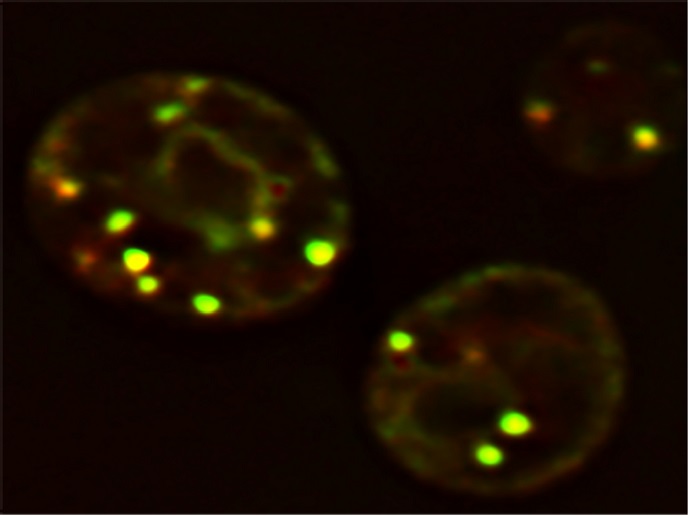
Genauere Kenntnisse zur Bildung von Lipidtröpfchen sind Voraussetzung, um die Pathophysiologie von Adipositas und Begleiterkrankungen wie Typ-2-Diabetes, Atherosklerose und Fettlebererkrankungen zu enthüllen. Die Biogenese von Lipidtröpfchen findet in den verzweigten Membranen des Zytoplasmas statt, dem endoplasmatischen Retikulum (ER). In obiger Abbildung sind gelb fluoreszierende Lipidtröpfchen in Hefezellen dargestellt. Wenig ist jedoch über die Faktoren bekannt, die den Ort der LD-Biogenese definieren. Unterstützt durch die Marie-Skłodowska-Curie-Maßnahmen „lag der Schwerpunkt des Projekts LD_Biogenesis darauf, den Ort der LD-Biogenese im endoplasmatischen Retikulum zu identifizieren und zu charakterisieren“, erklärt Forschungsstipendiat Vineet Choudhary.
Kooperation zwischen Proteinen und Biogenesefaktoren
Den Forschungsergebnissen zufolge bilden sich Lipidtröpfchen im ER nicht spontan an zufälligen Stellen, sondern an vordefinierten spezifischen ER-Stellen. Nach der Markierung durch das Protein Seipin wirken diese Stellen mit mehreren Faktoren der LD-Biogenese zusammen und initiieren die Bildung der Tröpfchen. Interessant ist, dass das nicht-enzymatische Protein Seipin an der Entstehung von Lipodystrophie-Syndromen beteiligt ist, einer Gruppe von Erkrankungen, die sich durch selektiven Verlust von Fettgewebe manifestieren. „Da Seipin wesentliche Voraussetzung für den Beginn der LD-Biogenese ist, führt eine Seipindefizienz zur ektopischen (verlagerten) Bildung von Lipidtröpfchen“, sagt Choudhary. Die Ergebnisse der Forschungen wurden im Fachblatt Journal of Cell Biology veröffentlicht. An genetisch veränderten Stämmen der Bäckerhefe Saccharomyces cerevisiae wurde demonstriert, wo der Zusammenbau der Lipidtröpfchen im endoplasmatischen Retikulum erfolgt, und mit einer neuen Fluoreszenzsonde die Akkumulierung von Triacylglycerin (TG) sichtbar gemacht. Mittels Fluoreszenz- und Elektronenmikroskopie wurde anschließend eine Karte der relevanten Subdomänen erstellt. Ein genetischer Knock-Out der LD-Biogenesefaktoren zeigte, dass die Kooperation zwischen Seipin und dem Protein Nem1 Voraussetzung für die Bildung funktioneller LD-Biogenesestellen ist. Seipin-Nem1-Stellen sind zusammen mit anderen Faktoren der LD-Biogenese (u. a. das Membranprotein Pex30) für die Bildung und das Wachstum von Lipidtröpfchen zuständig. Zur möglichen Rolle von Seipin erklärt Choudhary: „Wir konnten aufzeigen, wie Seipindefizienz dazu führt, dass die Bildung von Triacylglycerin an beliebigen Stellen im endoplasmatischen Retikulum stattfindet und Lipidtröpfchen dadurch fehlerhaft und an den falschen Stellen assembliert werden.“ Eine interessante Frage für weitere Forschungen ist nun, wie sich die fehlerhafte Biogenese von Lipidtröpfchen bei Lipodystrophie manifestiert.
Problemlösung mit teilweise überraschenden Ergebnissen
„Erst nach Optimierung einiger Parameter gelang uns die technische Realisierung der korrelativen Licht- und Elektronenmikroskopie“, erklärt Choudhary. „Zudem musste die Expression und Aufreinigung ausreichender Mengen der TG-Synthase sLro1 optimiert werden, um Lipidbindungstests in vitro durchführen zu können.“ Ein durchaus überraschendes Ergebnis der Studie ist, dass Seipin wie auch Nem1-Proteine sogar ohne Lipidtröpfchen an diskrete ER-Stellen binden. Die Ursache für deren Ko-Lokalisierung an diesen Subdomänen des endoplasmatischen Retikulums herauszufinden, ist eine weitere interessante Forschungsfrage. „Ob dies durch Protein- oder Lipid-Signale oder deren Kombination vermittelt wird, muss also noch untersucht werden. Genauere Kenntnisse über die Bildung dieser ER-Subdomänen könnten dann dazu beitragen, den Mechanismus der LD-Biogenese zu entschlüsseln“, zeigt sich Choudhary begeistert. Für ihn wird dies Thema künftiger Forschungen sein.
Schlüsselbegriffe
LD_Biogenese, LD, ER, Seipin, Fettleibigkeit, Lipidtröpfchen, endoplasmatisches Retikulum