Forschung zu molekularen Mechanismen von Ionenkanälen in Nierenzellen
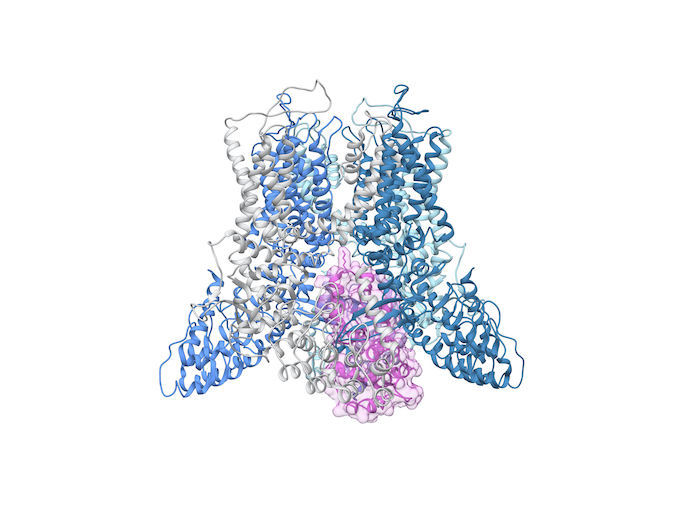
Der Ionenkanal TRPV5 (Transient Receptor Potential Vanilloid Channel), entdeckt 1999 an der Physiologischen Fakultät der Radboud-Universität, ist auf den Durchlass von Kalzium spezialisiert. Das Mineral ist unter anderem für die Gesundheit von Zähnen und Knochen und die Osteoporoseprävention wichtig. Allerdings blieb die Funktion des Kalziumkanals bislang weitgehend ungeklärt, insbesondere auch das Aussehen der molekularen Maschine, die das Öffnen und Schließen des Kanals koordiniert. „Prinzipiell wollten wir neue detaillierte molekulare Einblicke in den Kalziumkanal TRPV5 geben“, sagt Jenny van der Wijst, Koordinatorin des Projekts CRYO-EM TRPV5 an der SKU – Radboud-Universität Nijmegen.
Erstellung einer 3D-Proteinkarte
„Bislang war es eher schwierig, die Atomstruktur großer Membranproteine wie etwa TRPV5 abzubilden. Eine Lösung sahen wir im Kryo-Elektronenmikroskop (Kryo-EM), einer bahnbrechenden Technologie, die 2017 mit dem Nobelpreis ausgezeichnet wurde“, erklärt Jenny van der Wijst. Das EU-finanzierte Projekt forschte am TRPV5-Protein, das aus Säugetierzellen aufgereinigt und in Lipid-Nanodiscs rekonstituiert wurde, d. h. kleinen, scheibenförmigen Lipiddoppelschichten, die von einem Membrangerüstprotein umgeben sind. Für die Forschungen wurden große Mengen des Proteins in Wasser gegeben, um sich frei bewegen zu können. Jenny van der Wijst arbeitete eng mit Yifan Cheng von der University of California zusammen, dessen strukturbiologische Expertise ihr biophysikalisches Fachwissen zur Funktion von Ionenkanälen ergänzte. „Mit dem Hightech-Mikroskop machten wird 2D-Aufnahmen von eingefrorenen Proben der Proteine aus allen Perspektiven. Aus Tausenden von 2D-Bildern erstellten wir ein 3D-Bild von TRPV5, und zwar mittels einer chimärenspezifischen Software für die interaktive Abbildung und Analyse molekularer Strukturen“, erklärt Jenny van der Wijst, deren Arbeit über die Marie-Skłodowska-Curie-Maßnahmen finanziert wurde.
Neue Therapeutika in Aussicht
„Wir erstellten mehrere hochauflösende Strukturen von TRPV5, um neue Erkenntnisse zu pathophysiologischen Prozessen zu gewinnen, d. h. den Einfluss verschiedenster Krankheiten auf menschliche Körperfunktionen“, fügt sie hinzu. Die detaillierten Strukturanalysen könnten zeigen, wie aus einer genetischen Mutation eine Funktionsstörung wird: „Insbesondere bei TRPV5 sind mehrere genetische Varianten als Ursache für Nierensteine bekannt.“ Die Informationen, die sich aus hochauflösenden Strukturen gewinnen lassen, könnten letztlich die Wirkung pharmakologischer Substanzen aufzeigen und so die Wirkstoffforschung unterstützen. Van der Wijst fügt hinzu, dass TRP-Kanäle mit verschiedensten Nieren- und Darmerkrankungen in Zusammenhang gebracht werden. „Es daher unerlässlich, den Einfluss molekularer Komponenten, wie natürlicher oder synthetischer Substanzen und Lipide, auf Ionenkanäle genauer zu erforschen.“ Aus dem inzwischen abgeschlossenen Projekt gingen neue Forschungsvorhaben hervor, die nun vom Niederländischen Forschungsrat finanziert werden. „Das Projekt verschaffte uns nicht nur eine klarere Vorstellung von der Struktur des Ionenkanals, sondern auch davon, wie dieser durch das assoziierte Protein Calmodulin blockiert werden kann. Noch ist unklar, wie dadurch der Kalziumfluss über TRPV5 gesteuert wird. Wir sehen nur, dass der Kanal fest verschlossen wird“, schließt Jenny van der Wijst. Im nächsten Schritt soll nun das Öffnen und Schließen des TRPV5-Kanals genauer erforscht werden.
Schlüsselbegriffe
CRYO-EM TRPV5, Kalzium, Calmodulin, Kryo-Elektronenmikroskop, Ionenkanäle, Niere, Membranproteine, Nanodiscs, Pathophysiologie, TRPV5