Explorer la machinerie moléculaire des passerelles des cellules rénales
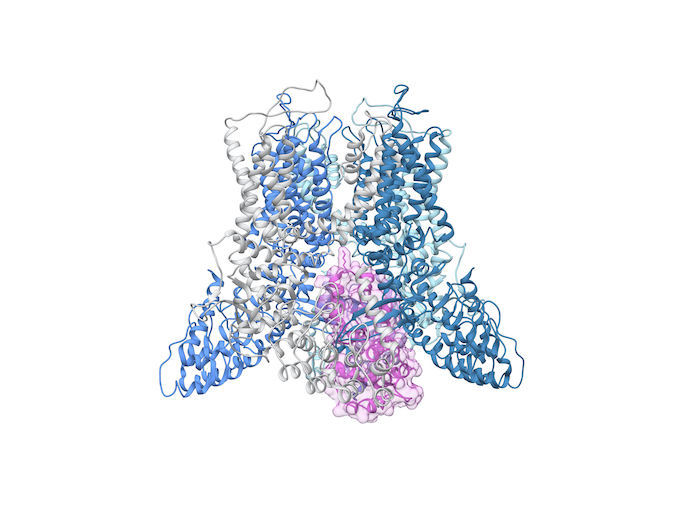
Découvert par le département de physiologie de l’Université Radboud en 1999, le TRPV5 (canal vanilloïde potentiel de récepteur transitoire) permet spécifiquement le passage du calcium. Ce minéral est entre autres vital pour la santé des os et des dents, ainsi que pour la prévention de l’ostéoporose. Mais on ne savait pas jusqu’ici comment ce canal calcique fonctionnait exactement. À quoi ressemble la machine moléculaire qui assure l’ouverture et la fermeture de la porte? «Notre objectif principal consistait à fournir des informations moléculaires détaillées sur ce canal calcique TRPV5», déclare Jenny van der Wijst, coordinatrice du projet CRYO-EM TRPV5, hébergé par la SKU — l’Université Radboud de Nimègue.
Créer une carte de protéines 3D
«Jusqu’à récemment, il était difficile de visualiser la structure atomique des grandes protéines membranaires comme la TRPV5. Nous nous sommes donc tournés vers le microscope cryo-électronique, ou cryo-EM pour faire court, une technique révolutionnaire récompensée par le prix Nobel en 2017 », explique Jenny van der Wijst. Le projet soutenu par l’UE a utilisé la protéine TRPV5 purifiée à partir de cellules de mammifères et reconstituée dans des lipides nanodisques, de petites bicouches lipidiques en forme de disque entourées d’une protéine d’échafaudage membranaire. Ces protéines ont été ajoutées en grande quantité à de l’eau, où elles pouvaient se déplacer librement. Jenny van der Wijst a travaillé en étroite collaboration avec Yifan Cheng, de l’Université de Californie, dont l’expertise en biologie structurale correspondait à l’expérience biophysique de Jenny van der Wijst dans le fonctionnement des canaux ioniques. «Nous avons congelé les échantillons et, à l’aide de ce microscope de pointe, avons pris des photos 2D des protéines sous toutes sortes d’angles. À l’aide d’un logiciel spécialisé dans la chimère pour la visualisation et l’analyse interactives des structures moléculaires, nous avons construit une image 3D de la TRPV5 à partir de milliers d’images 2D», remarque Jenny van der Wijst, qui a reçu le soutien du programme actions Marie Skłodowska-Curie.
La thérapeutique à l’horizon
«Nous avons produit plusieurs structures haute résolution de TRPV5. Celles-ci pourraient améliorer la compréhension de la physiopathologie, c’est-à-dire des effets de la maladie sur la fonction corporelle, de diverses maladies humaines », ajoute-t-elle. Cette analyse structurelle détaillée peut démontrer comment une mutation génique conduit à une fonction altérée: «Spécifiquement pour la TRPV5, nous connaissons plusieurs variantes génétiques liées à la maladie des calculs rénaux.» Les connaissances acquises à partir de structures haute résolution pourraient finalement soutenir les programmes de développement de médicaments, car elles peuvent fournir un aperçu des actions des composés pharmacologiques. Jenny van der Wijst ajoute que les canaux TRP sont liés à diverses conditions pathologiques ayant un impact sur les reins et les intestins. «Il est donc important de bien comprendre comment les composants moléculaires, tels que les substances et les lipides naturels ou non naturels, affectent les canaux ioniques.» Bien que le projet soit terminé, il a suscité de nouvelles recherches financées par le Conseil néerlandais de la recherche. «En plus d’avoir une idée claire de la structure du canal ionique, nous avons également visualisé son blocage par une protéine associée appelée calmoduline.» «La manière dont elle contrôle le flux de calcium à travers la TRPV5 reste un mystère, même si nous voyons qu’elle bloque le passage, à la manière d’un bouchon dans une bouteille de vin», conclut Jenny van der Wijst. L’étape suivante consiste à apporter un nouvel éclairage sur ce mécanisme marche-arrêt dans le canal TRPV5.
Mots‑clés
CRYO-EM TRPV5, calcium, calmoduline, microscope cryo-électronique, canaux ioniques, rein, protéines membranaires, nanodisques, physiopathologie, TRPV5