Prophages: un nouvel agent pour le transfert de gènes de résistance aux antibiotiques
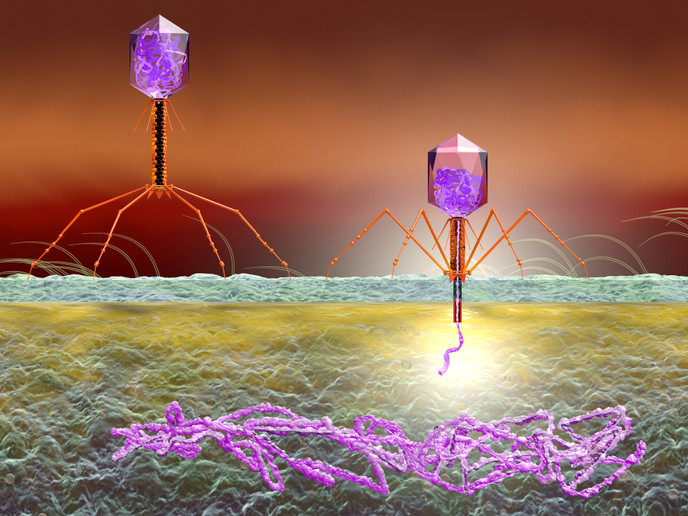
Les bactériophages sont des virus qui infectent des bactéries et qui peuvent être soumis à un cycle de vie lytique ou lysogénique. Lors du cycle lytique, les phages se multiplient et libèrent de nouveaux virions, des cellules hôte de lyse, tandis que durant le cycle lysogénique, les phages incorporent leur propre matériel génétique dans les chromosomes bactériens, formant ainsi des prophages. Ce mécanisme facilite le transfert de nouveaux gènes dans les bactéries, notamment les GRA, ce qui favorise l’adaptation des bactéries à de nouvelles conditions environnementales. Toutefois, notre compréhension de l’évolution des prophages porteurs de GRA est incomplète.
Évaluer le coût et les bénéfices d’adaptation des prophages vers les cellules hôtes
Le projet ProphARG avait pour objectif d’étudier la manière dont les prophages affectent l’adaptation des bactéries. Entreprises avec le soutien du programme Actions Marie Skłodowska-Curie, des expériences ont été conçues pour étudier l’évolution des prophages porteurs de GRA et leur impact sur la bactérie hôte Escherichia coli. «Notre objectif était d’étudier l’effet des prophages sur des hôtes bactériens en termes de résistance aux antibiotiques et de maladies infectieuses chez l’être humain et l’animal», explique Carolin Charlotte Wendling, chargée de recherche MSCA. Afin de quantifier l’adaptation relative des bactéries, les chercheurs ont effectué des analyses de compétition par paires sur les bactéries contenant un prophage, et d’autres sans. Afin de parvenir à des conclusions sur un large éventail de types de gènes de résistance et de bactériophages, ils ont employé des prophages de synthèse plutôt que naturels, où une région génomique non-essentielle du phage avait été remplacée par un GRA. Les compétitions dans de multiples environnements ont été entreprises afin de distinguer les différents effets d’adaptation des prophages porteurs de GRA de ceux exempts de GRA. Les résultats ont montré que les conditions environnementales ont dicté les bénéfices ou le coût d’adaptation des prophages vers les bactéries hôtes. En l’absence d’antibiotiques ou d’autres conditions de stress, les GRA et les prophages ne présentaient aucun coût pour leurs hôtes. Dans des conditions favorisant le cycle lytique, telles que l’exposition à la lumière UV ou à d’autres agents responsables des lésions de l’ADN, l’adaptation des bactéries dotées de prophages était plus élevée que celle des bactéries sans prophage. Cela tient au fait que les prophages sont revenus au cycle lytique et ont éliminé les bactéries concurrentes sans phage. À l’inverse, en présence d’antibiotiques, les bactéries dotées de prophages porteurs de GRA ont mieux survécu dans la mesure où elles ont pu résister à l’action des antibiotiques. «Les GRA ont présenté un avantage à des concentrations plus élevées d’antibiotiques», souligne Carolin Charlotte Wendling.
Impact clinique de ProphARG
Les bactéries multirésistantes représentent une menace clinique importante, en freinant l’efficacité des antibiotiques existants et en mettant en péril des milliers d’individus lors d’interventions de routine. Les bactériophages sont depuis longtemps connus pour leurs effets protecteurs sur l’hôte, en lui conférant une immunité contre les phages surinfectants, et en les aidant à résister aux antibiotiques à travers l’action bénéfique des GRA. En outre, les prophages, qui constituent jusqu’à 20 % du génome bactérien, contribuent à la diversité génomique au sein des isolats bactériens. Les découvertes de ProphARG soulignent la contribution des prophages en tant qu’agents causaux du transfert de GRA, alors que jusqu’à présent, la recherche s’était largement centrée sur les plasmides. Les concentrations sous-inhibitrices d’antibiotiques semblent favoriser le transfert horizontal des GRA encodés par les phages, et contribuent à la diffusion de la résistance aux antibiotiques. Par conséquent, les stratégies de traitement aux antibiotiques doivent être personnalisées afin de réduire le risque d’induire les prophages et le transfert des GRA à d’autres membres de la population bactérienne. Mieux comprendre les moteurs de l’adaptation bactérienne permet d’aider à prédire la diffusion des GRA des environnements agricoles ou naturels vers le microbiote humain ou les agents pathogènes. À l’avenir, Carolin Charlotte Wendling entend «élargir les découvertes de ProphARG en étudiant l’influence des prophages dans la diffusion de plasmides multirésistants au sein de communautés bactériennes».
Mots‑clés
ProphARG, prophage, GRA, résistance aux antibiotiques, adaptation bactérienne, gène de résistance