El papel del metabolismo de la glucosa en el cáncer colorrectal
En la década de 1950, un científico alemán llamado Otto Warburg descubrió que las células cancerosas metabolizaban la glucosa de manera diferente a las células normales. Hoy sabemos que, en las células cancerosas, la mayoría de las vías metabólicas celulares están «reconectadas», lo que se conoce como reprogramación metabólica. De este modo, las células cancerosas crecen, proliferan y sobreviven y por tanto, esta reconexión está íntimamente ligada con la progresión del tumor, la metástasis y la resistencia terapéutica. Estudios recientes sobre el cáncer colorrectal sugieren que el metabolismo de la glucosa modifica las células madre intestinales, de las que se origina este tipo de cáncer. Sin embargo, no se conoce el mecanismo preciso de este proceso. En MDCRC, proyecto perteneciente a las Acciones Marie Skłodowska-Curie, se identificó y caracterizó un nuevo tipo de célula epitelial intestinal altamente glucolítica, es decir, que consume mucha glucosa. Esto permite que los tumores cancerosos crezcan y se diseminen. Estas células glucolíticas también tienen una capacidad similar a la de una célula madre para dar lugar a las diferentes células presentes en el epitelio intestinal. También se ha demostrado que contribuían al inicio de tumores intestinales. «Nuestros resultados podrían inspirar terapias nuevas contra el cáncer colorrectal, al interferir con las adaptaciones metabólicas específicas de las células iniciadoras de tumores», afirma el beneficiario de una beca Marie Skłodowska-Curie Carlos Sebastián del Candiolo Cancer Institute, entidad anfitriona del proyecto.
Descubrimiento de células altamente glucolíticas
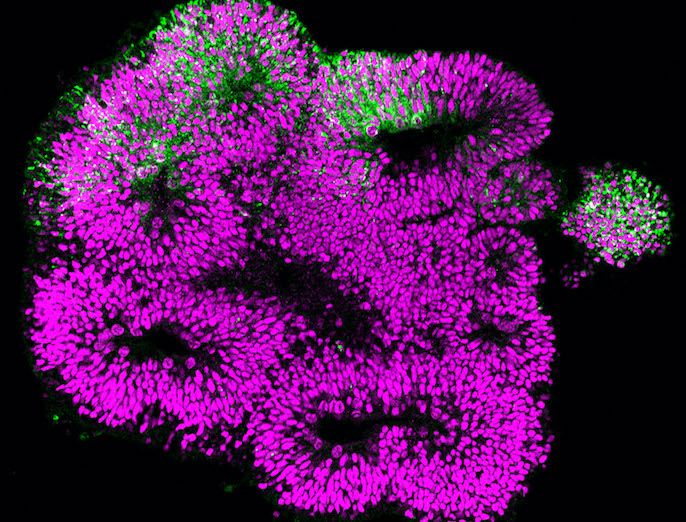
El trabajo anterior del equipo de MDCRC había demostrado que la reprogramación del metabolismo de la glucosa era un paso fundamental para iniciar los tumores intestinales. Al mismo tiempo, otros investigadores descubrieron que la transformación de las células madre intestinales daba lugar a tumores intestinales. En el proyecto MDCRC se combinaron ambas observaciones y se propuso que el metabolismo de la glucosa podría regular la iniciación del tumor al influir en la biología de las células madre intestinales. El equipo desarrolló una guía metabólica novedosa, fluorescente y codificada genéticamente para visualizar, rastrear y aislar células con diferentes propiedades metabólicas dentro del epitelio intestinal. «Este sistema permitió por primera vez obtener imágenes, rastrear y caracterizar células con diferentes propiedades metabólicas dentro del microentorno nativo de los tejidos vivos, y proporcionar así un nivel de detalle sin precedentes», explica Sebastián. El equipo utilizó estructuras 3D llamadas organoides, derivadas de modelos de ratón de cáncer colorrectal, que imitaban la composición celular del intestino. «El estudio de la formación de estos organoides ofreció información sobre células altamente glucolíticas, muchas con funciones de células madre. Es más, los ensayos confirmaron que estas células glucolíticas también inician tumores», añade Sebastián. La inmunotinción y los experimentos de expresión génica permitieron al equipo caracterizar el fenotipo de estas células, lo que indicó de qué tipo específico de célula epitelial intestinal eran sus células altamente glucolíticas. El empleo de técnicas químicas y genéticas ofreció al equipo la posibilidad de inhibir la glucólisis en estas células, lo que redujo sus capacidades como células madre, esto es, formaron menos organoides en los ensayos. Como solo las células madre pueden dar lugar a estos organoides, se demostró que el metabolismo de la glucosa regula la actividad de las células madre.
Hacia terapias nuevas
El cáncer colorrectal es el segundo cáncer más común en Europa y el tercero en todo el mundo. Aunque los avances recientes en la genética molecular del cáncer colorrectal han ayudado a diseñar nuevas terapias dirigidas, la mayoría de los pacientes aún recaen y sucumben a esta enfermedad mortal. Además del impacto obvio en los pacientes y sus familias, esta realidad supone una carga significativa para los sistemas de salud. «Al aportar más datos sobre los mecanismos moleculares subyacentes, nuestros resultados podrían beneficiar a los pacientes», concluye Sebastián. Actualmente, el equipo continúa con una serie de experimentos para caracterizar completamente el rango de actividad metabólica asociada con el cáncer colorrectal. También está aplicando sus hallazgos a humanos utilizando organoides derivados de tumores de los pacientes, que se trasplantan a intestinos de ratón para observar el crecimiento del tumor.
Palabras clave
MDCRC, cáncer colorrectal, glucosa, metabolismo, intestinal, células epiteliales, células madre, tumores, glucolítico, reprogramación metabólica, organoides