Innovative Arzneimittel auf Goldbasis für die geführte Krebstherapie
Das therapeutische Potenzial metallbasierter Verbindungen ist nicht neu: Es reicht bis in das antike Griechenland und das alte China zurück. Arzneimittel auf Platinbasis wie Cisplatin und seine Derivate werden als Krebsmedikamente eingesetzt. Es wächst jedoch die Nachfrage nach alternativen metallbasierten Verbindungen mit verstärkter Zytotoxizität, verbesserter Pharmakokinetik und weniger Nebenwirkungen.
Neuartige goldbasierte Verbindungen
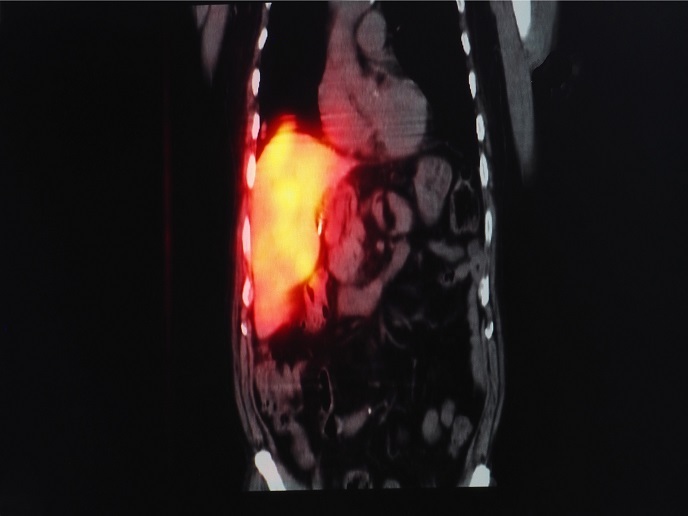
Im Rahmen des mit Unterstützung der Marie-Skłodowska-Curie-Maßnahmen durchgeführten Projekts PhoRAu wurden mit Radioisotopen versetzte Verbindungen auf Basis von Gold(III) entwickelt. Das Forschungsteam wollte herausfinden, wann und wie Gold(III)-Prodrugs in Gold(I)-Arzneimittel überführt werden. „Diese vielversprechende Molekülklasse kann tatsächlich neuartige Zytotoxizitätsmechanismen hervorrufen, da die Moleküle potenziell eine kontrollierte Reduktion zu Gold(I)-Verbindungen in Zellkompartimenten durchlaufen“, erklärt der Marie-Skłodowska-Curie-Stipendiat Alessio Terenzi. Die Forschenden wollten die Therapie mit Bildgebungsfunktionen kombinieren und markierten die Gold-Prodrugs daher mit radioaktivem Iodid. Das ermöglichte die In-vivo-Beobachtung der Biodistribution des Prodrug mithilfe von Positronenemissionstomografie (PET), ähnlich der mit radioaktivem Fluorid markierten Glukose zur Tumorbildgebung in der Onkologie. Im Gegensatz zu herkömmlichen Strategien, bei denen Radionuklide kovalent an organische Moleküle gebunden werden, nutzte das Forschungsteam von PhoRAu anorganische Reaktionsmechanismen zur Markierung. Wichtig war, dass die einfache anorganische Reaktion zwischen radioaktivem Iodid und Gold(I) das gewünschte Gold(III)-Prodrug ergab, das sie herstellen wollten. Außerdem untersuchten sie die Thermodynamik, die Kinetik und die Redoxeigenschaften dieser Gold(III)-Komplexe in wässriger Lösung und in Gegenwart biologischer Moleküle. Durch Untersuchungen der Biodistribution der Gold(III)-Prodrugs konnte das Forschungsteam den Reduktionsprozess von Gold in vivo beobachten und herausfinden, wie Gold(III)-Komplexe verstoffwechselt und aktiviert werden. Mithilfe der PET-Bildgebung konnte gezeigt werden, dass das Gold(III)-Prodrug über den Blutkreislauf in die wichtigen Organe wie die Lunge, die Nieren und die Leber gelangt und dort eingelagert wird. Interessanterweise wurde das Gold(III)-Prodrug nicht sofort zu seinem Gold(I)-Analogon reduziert, sondern erreichte einige Organe in seiner oxidierten Form. Dies lieferte wichtige Erkenntnisse über goldbasierte Therapeutika.
Projektdynamik
Durch die radioaktiven Goldderivate konnte das Forschungsteam von PhoRAu seine Prodrug-Kandidaten auf Goldbasis um eine Bildgebungsfunktion erweitern und so eine PET-geführte Therapie ermöglichen. „Unsere Strategie überwindet eine inhärente Beschränkung der metallbasierten Arzneimittel, die in vivo kaum in Echtzeit beobachtet werden können“, sagt Terenzi. Bedeutend ist, dass die Methode auf einem originären Markierungskonzept basiert, das auch weitere Anwendung in der Markierung anderer metallbasierter Krebstherapeutika finden kann. Außerdem gaben die Daten zur Wechselwirkung zwischen Gold(III)- und Gold(I)-Spezies in vitro und in vivo Aufschluss über die Wirkmechanismen dieser Familie von Krebsmedikamentenkandidaten. In-vivo-Untersuchungen der Biodistribution von Goldkomplexen sind noch wenig verbreitet. Daher ist die Arbeit von PhoRAu in diesem Bereich zukunftsweisend. Auch wenn die klinische Anwendung dieser Kandidatenverbindungen erst in einigen Jahren zu erwarten ist, merkt Terenzi an: „Unser Ansatz wird andere Menschen anregen und zur Entwicklung von Arzneimitteln führen, die letztlich für klinische Prüfungen zugelassen werden.“
Schlüsselbegriffe
PhoRAu, Gold, metallbasierte Arzneimittel, Krebs, radioaktives Iodid, Markierung, PET-Bildgebung, photodynamische Therapie