Revolutionäres Diagnoseinstrument unterscheidet zwischen viralen und bakteriellen Infektionen
Weltweit begeben sich jährlich rund 3 Mrd. Betroffene bei einem Verdacht auf eine akute Infektion in ärztliche Behandlung. Anamnese, körperliche Befunde und weitere zusätzliche medizinische Untersuchungen liefern oft kein eindeutiges Ergebnis. Eine Fehldiagnose der Krankheitsätiologie kann den eingeschlagenen Weg der Patientenversorgung verändern und in unnötige Diagnosetests oder eine überflüssige Verschreibung von Antibiotika münden.
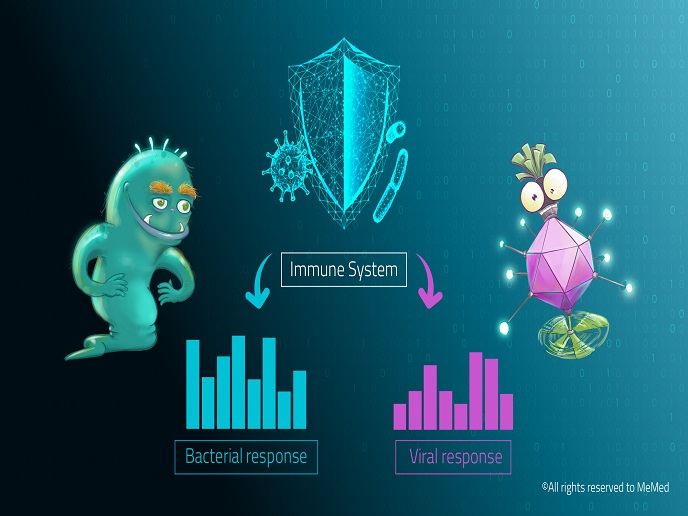
Wirtssignatur unterscheidet zwischen bakterieller und viraler Infektion
Forschende des EU-finanzierten Projekts AutoPilot-Dx haben einen neuartigen Assay auf Basis von ELISA entwickelt, der exakt unterscheiden kann, ob die Infektion durch Viren oder Bakterien verursacht wurde. ImmunoXpert™ misst die Konzentration von drei Wirtsproteinen: Tumornekrosefaktor-verwandter Apoptose-induzierender Ligand (TRAIL), Interferon Gamma-induziertes Protein-10 (IP-10) und C-reaktives Protein (CRP). „Diese Proteine zeigen eine charakteristische Expression und komplementäre Dynamik in den Wirtsreaktionen auf bakterielle bzw. virale Infektionen“, erklärt Tanya Gottlieb, Vizepräsidentin für wissenschaftliche Angelegenheiten bei MeMed. Die auf diesen drei Wirtsproteinen beruhende Signatur wurde zuvor vom Konsortium entdeckt und in der groß angelegten Prospektivstudie „Curiosity“ validiert. Für die Studie wurden Proben von mehr als 1 000 Erwachsenen und Kindern genutzt, die an einer Infektion litten. Die Signatur mit der Bezeichnung BV™ zeigte bei mehreren Pathogenen eine Sensitivität von 92 % und eine Spezifizität von über 89 %. Damit übertrifft sie routinemäßig angewandte Biomarker. Sie wurde außerdem in zwei doppelblinden externen klinischen Studien bestätigt, an der mehr als 1 300 Kinder teilnahmen. BV™ kann manuell oder über eine robotergestützte Plattform anhand des ImmunoXpert™-Immunoassays gemessen werden. Das Testergebnis liegt zwischen 0 und 100 Punkten, wobei eine niedrige Punktzahl von einer viralen und eine hohe Punktzahl von einer bakteriellen Infektion zeugt.
Klinische Bedeutung der BV™-Immunsignatur
10 bis 25 % der kindlichen Patienten in der Notaufnahme leiden an Fieber, bei 20 % von ihnen lässt sich die Ursache nicht feststellen. Die diagnostische Unsicherheit zeigt sich daran, dass weltweit immer häufiger Antibiotika verschrieben werden, was wiederum grundlegende individuelle und globale Gesundheitsfolgen mit sich bringt. Ein Beispiel hierfür ist die Ausbreitung von Antibiotikaresistenzen. BV™ kann die Behandlung von pädiatrischen Patientinnen und Patienten mit Atemwegsinfektionen und Fieber unklarer Genese, die rund 50 % der Arztbesuche ausmachen, entscheidend verbessern. Zur Beurteilung des klinischen Nutzens von BV™ haben Forschende errechnet, dass der Assay die unnötige Verabreichung von Antibiotika bei Kindern um 87 % und bei Erwachsenen um 91 % reduzieren kann. „BV™ ist ein innovatives und handlungsfähiges Instrument, mit dem klinische Fachkräfte fundiertere Entscheidungen zur Behandlung von Patienten mit Verdacht auf eine akute Infektion treffen können. Somit lässt sich der übermäßige Einsatz von Antibiotika bekämpfen, ohne die Patientensicherheit zu beeinträchtigen“, betont Gottlieb. Der europäische Markt für die ImmunoXpert™-Diagnose wird auf 1 Mrd. EUR geschätzt, wobei das Instrument zuerst in der Notaufnahme und auf der Kinderstation in Krankenhäusern eingesetzt werden soll. Die AutoPilot-Dx-Partner entwickeln derzeit außerdem eine Point-of-Care-Plattform namens Key™. Dank dieser wird sich der BV™-Test bei Bedarf jederzeit und überall durchführen lassen. Die entsprechenden Ergebnisse werden dabei innerhalb von 15 Minuten zur Verfügung stehen. Die Markteinführung soll 2020 zunächst in Europa und anschließend in den Vereinigten Staaten erfolgen. „Wir wollen mit unserem Unternehmen die Signale der Wirtsreaktion in einfache Informationen entschlüsseln, die das Leben der Menschen verbessern“, so Gottlieb abschließend. Die Projektpartner arbeiten aktuell an innovativen Diagnosen auf Basis der Wirtsreaktion zur Behandlung von Sepsis. Außerdem wollen sie die Messfähigkeit von Key™ nutzen, um neue Tests auf den Markt zu bringen.
Schlüsselbegriffe
AutoPilot-Dx, Virusinfektion, bakterielle Infektion, ImmunoXpert™, Tumornekrosefaktor-verwandter Apoptose-induzierender Ligand (TRAIL), Interferon Gamma-induziertes Protein-10 (IP-10), C-reaktives Protein (CRP)