Una sofisticata tecnologia fa luce sul processo dell'errato ripiegamento proteico
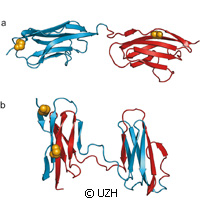
Il ripiegamento delle proteine è necessario per il funzionamento delle strutture tridimensionali nel corpo. Alcune parti delle proteine funzionali possono però rimanere non ripiegate, portando alla generazione di varie malattie debilitanti come le malattie neurodegenerative. Alcuni ricercatori in Svizzera e nel Regno Unito hanno studiato l'errato ripiegamento delle proteine usando una sofisticata tecnica spettroscopica. Presentato sulla rivista Nature, lo studio rivela come l'errato ripiegamento può competere con il ripiegamento produttivo in particolare in proteine che contengono molti campi. Lo studio è stato in parte finanziato da una borsa di studio intraeuropea Marie Curie nell'ambito del Settimo programma quadro (7° PQ) dell'UE. Ricercatori dell'Università di Zurigo e dell'Università di Cambridge spiegano che il misfolding avviene con più frequenza quando la sequenza di aminoacidi nei campi proteici vicini è molto simile. Gli esperti definiscono le proteine come le principali macchine molecolari nel nostro corpo. Il loro ruolo è molto ampio: non solo trattano le sostanze nutritive e le trasformano in energia ma aiutano la struttura cellulare e trasmettono segnali nelle cellule e in tutto il corpo. Le proteine devono assumere una struttura ben definita e tridimensionale per assicurare l'espletamento delle loro funzioni specifiche e per lo più trovano questa struttura da sole una volta che si sono formate a partire dai singoli mattoni, gli aminoacidi, come una lunga catena di molecole nella cellula. Un errore nel processo di ripiegamento però risulta in proteine che non sono in grado di svolgere le loro funzioni. Così emergono vari disturbi, ma evitare il processo di ripiegamento errato non è facile come può sembrare. Le stesse interazioni proteiche che stabilizzano la struttura corretta delle proteine individuali possono provocare interazioni tra molecole di proteine e a sua volta costringerle a ripiegarsi in modo errato. Usando un metodo di fluorescenza a molecola singola, il team ha esaminato cosa succede quando si verifica il ripiegamento errato. Hanno sondato campi, o sezioni, di titina, che è la più grande proteina del corpo umano. La titina contribuisce alla stabilità e all'elasticità delle fibre muscolari. È necessario precisare che campi individuali di titina possono spiegarsi mentre il muscolo è molto stirato per evitare che il tessuto muscolare venga danneggiato, ma quando i muscoli si rilassano nuovamente, può verificarsi un ripiegamento errato dei campi. Il team ha attaccato piccolissime molecole di colorante come sonde alle proteine ai fini di questo studio. "Usando il nostro metodo con laser spettroscopico siamo riusciti a determinare le distanze su scala molecolare, cioè fino a pochi milionesimi di millimetro, attraverso il trasferimento di energia tra le sonde," dice uno degli autori dello studio, il professor Benjamin Schuler dell'Università di Zurigo. Ciò ha permesso al team di identificare le strutture correttamente e di distinguere le proteine erroneamente ripiegate. I ricercatori hanno così determinato la proporzione del misfolding. "Lo studio di diversi campi di titina nei nostri esperimenti ha rivelato che la probabilità di misfolding aumenta se i campi vicini sono molto simili nella sequenza di aminoacidi," spiega. "Questo sembra essere una strategia evolutiva fondamentale per evitare l'errato ripiegamento delle proteine e per garantire così la loro massima funzionalità."Per maggiori informazioni, visitare: Nature: http://www.nature.com/ Università di Zurigo: http://www.uzh.ch/index_en.html
Paesi
Svizzera, Regno Unito