Spezielle Technologie beleuchtet falsch gefaltete Proteine
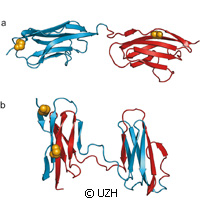
Durch die Proteinfaltung erhalten Proteine ihre dreidimensionalen Strukturen im Körper. Teilweise kann die Faltung der funktionellen Proteine aber auch fehlschlagen, was zur Entstehung unter anderem von neurodegenerativen Krankheiten führt. Mithilfe einer speziellen Mikroskopietechnik haben Forscher in der Schweiz und im Vereinigten Königreich die Proteinfehlfaltung untersucht. Die in der Zeitschrift Nature vorgestellte Studie zeigt, wie Fehlfaltung mit produktiver Faltung konkurrieren kann, besonders bei Proteinen, die aus mehreren Domänen bestehen. Finanziert wurde die Forschung teilweise durch ein Intra-European Fellowship aus den Marie-Curie-Maßnahmen des Siebten Rahmenprogramms (RP7) der EU. Den Forschern von der Universität Zürich und der University of Cambridge zufolge treten Fehlfaltung häufiger auf, wenn die Abfolge der Aminosäuren in den benachbarten Proteindomänen sehr ähnlich ist. Unter Experten gelten Proteine als zentrale molekulare Maschinen in unserem Körper. Sie spielen eine vielfältige Rolle: von der Verarbeitung von Nährstoffen und der Umwandlung von Energie über die Strukturierung von Zellen bis zur Übermittlung von Signalen in Zellen und im gesamten Körper. Um diese hochspezifischen Funktionen erfüllen zu können, müssen Proteine eine wohldefinierte dreidimensionale Struktur annehmen. Und meistens finden sie diese Struktur ohne fremde Hilfe, nachdem sie in der Zelle als langes Kettenmolekül aus ihren Einzelbausteinen, den Aminosäuren, gebildet wurden. Ein Fehler bei der Proteinfaltung führt aber dazu, dass diese Proteine ihre Aufgaben nicht mehr wahrnehmen und verschiedenste Krankheiten auslösen können. Aber diese Fehlfaltung zu vermeiden ist nicht so einfach wie man denkt. Denn die gleichen molekularen Wechselwirkungen, die die korrekte Struktur des einzelnen Proteins stabilisieren, können auch zu Wechselwirkungen zwischen Proteinmolekülen und damit zu ihrer Fehlfaltung führen. Mithilfe der Einzelmolekülfluoreszenzspektroskopie hat das Forscherteam untersucht, unter welchen Voraussetzungen Fehlfaltung stattfindet. Dafür wurden Domänen (Abschnitte) des größten Proteins unseres Körpers, des Titins, untersucht. Titin trägt zur Stabilität und Elastizität von Muskelfasern bei. Man nimmt an, dass einzelne Teile des Titins, die Domänen, sich bei starker Belastung des Muskels entfalten können, um eine Beschädigung des Muskelgewebes zu verhindern. Wenn sich der Muskel wieder entspannt, besteht das Risiko, dass sich diese entfalteten Domänen falsch zusammenlagern. Für ihre Studie haben die Wissenschaftler kleine Farbstoffmoleküle als Sonden im Protein angebracht. "Mit unserer laserspektroskopischen Methode konnten mittels Energietransfer zwischen den Sonden Abstände auf molekularer Skala bestimmt werden, also im Bereich einiger Millionstel Millimeter", sagt Professor Benjamin Schuler von der Universität Zürich, einer der Autoren der Studie. So ließen sich die Strukturen richtig und falsch gefalteter Proteine unterscheiden und damit der Anteil an Fehlfaltung bestimmen. "Die Untersuchung verschiedener Domänen des Titins in unseren Experimenten hat gezeigt, dass die Wahrscheinlichkeit der Fehlfaltung steigt, wenn benachbarte Domänen sich in der Abfolge ihrer Aminosäuren sehr ähnlich sind", erklärt er. "Offenbar handelt es sich dabei um eine wichtige evolutionäre Strategie, um die Fehlfaltung von Proteinen zu vermeiden und so ihre maximale Funktionalität zu gewährleisten."Weitere Informationen unter: Nature: http://www.nature.com/ Universität Zürich: http://www.uzh.ch/
Länder
Schweiz, Vereinigtes Königreich