Zaawansowana technologia pomaga w wyjaśnieniu procesu niepoprawnego fałdowania białek
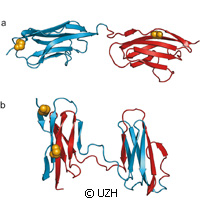
Fałdowanie białek jest niezbędne dla funkcjonowania trójwymiarowych struktur w organizmie. Bywa jednak tak, że niektóre części białek funkcjonalnych pozostają niepofałdowane, prowadząc do rozmaitych, wyniszczających schorzeń, takich jak choroby neurozwyrodnieniowe. Naukowcy ze Szwajcarii i Wlk. Brytanii zbadali niepoprawne fałdowanie białek z wykorzystaniem zaawansowanej techniki spektroskopowej. Wyniki zaprezentowane w czasopiśmie Nature ujawniają, jak nieprawidłowe fałdowanie może konkurować z produktywnym fałdowaniem, zwłaszcza w białkach zawierających wiele domen. Badania zostały częściowo dofinansowane z wewnątrzeuropejskiego stypendium Marie Curie z budżetu Siódmego Programu Ramowego (7PR) UE. Naukowcy z Uniwersytetu w Zurychu i Uniwersytetu Cambridge twierdzą, że nieprawidłowe fałdowanie występuje częściej, kiedy sekwencja aminokwasów w sąsiednich domenach białek jest bardzo podobna. Eksperci nazywają białka głównymi maszynami molekularnymi w naszym organizmie. Ich rola jest ogromna, bowiem nie tylko przetwarzają substancje odżywcze i przekształcają energię, ale również wspomagają strukturę komórek i przekazują sygnały w komórkach i w całym organizmie. Białka muszą mieć wyraźne zdefiniowaną, trójwymiarową strukturę, aby mogły wypełniać swoje specyficzne funkcje i w większości przypadków odnajdują tę strukturę samodzielnie po tym, jak zostają uformowane w komórce z pojedynczych modułów konstrukcyjnych - aminokwasów - w długie łańcuchy cząsteczek. Jednakże błędy w procesie fałdowania skutkują powstaniem białek, które są niezdolne do wypełniania swoich funkcji. W konsekwencji pojawiają się rozmaite zaburzenia. Jednak uniknięcie procesu nieprawidłowego fałdowania nie jest takie łatwe, jak mogłoby się wydawać. Ta sama reakcja molekularna, która stabilizuje prawidłową strukturę pojedynczych białek może wywołać interakcje między molekułami białek i przez to zmusić je do nieprawidłowego fałdowania. Za pomocą metody fluorescencyjnej pojedynczej molekuły zespół przeanalizował, co dzieje się w przypadku wystąpienia nieprawidłowego fałdowania. Naukowcy sprawdzili domeny (czy też odcinki) tytyny, która jest największym białkiem w organizmie. Tytyna wpływa na stabilność i elastyczność włókien mięśniowych. Należy zauważyć, że pojedyncze domeny tytyny mogą ulec rozfałdowaniu, kiedy mięsień jest poddawany intensywnemu wysiłkowi, aby uchronić tkankę mięśniową przed uszkodzeniem. Ale ponowne rozluźnienie mięśni może doprowadzić do wadliwego fałdowania domen. Na potrzeby badań zespół dołączył do białek malutkie molekuły barwne jako sondy. "Dzięki naszej metodzie spektroskopii laserowej byliśmy w stanie ustalić odległości w skali molekularnej, tj. z dokładnością do kilku milionowych milimetra, na podstawie transferu energii między sondami" - mówi współautor artykułu, profesor Benjamin Schuler z Uniwersytetu w Zurychu. To umożliwiło zespołowi właściwe zidentyfikowanie struktur i odróżnienie białek nieprawidłowo pofałdowanych. Następnie naukowcy określili proporcje nieprawidłowego fałdowania. "Badanie różnych domen tytyny w ramach naszych doświadczeń pokazało, że prawdopodobieństwo nieprawidłowego pofałdowania zwiększa się, jeżeli sąsiednie domeny mają bardzo podobną sekwencję aminokwasów" - wyjaśnia. "Wydaje się, że jest to kluczowa strategia ewolucyjna, której celem jest unikanie nieprawidłowego fałdowania białek, a przez to zapewnienie ich maksymalnej funkcjonalności."Więcej informacji: Nature: http://www.nature.com/ Uniwersytet w Zurychu: http://www.uzh.ch/index_en.html
Kraje
Szwajcaria, Zjednoczone Królestwo