Comprendre la clé du microbiome pour de meilleures thérapies intestinales
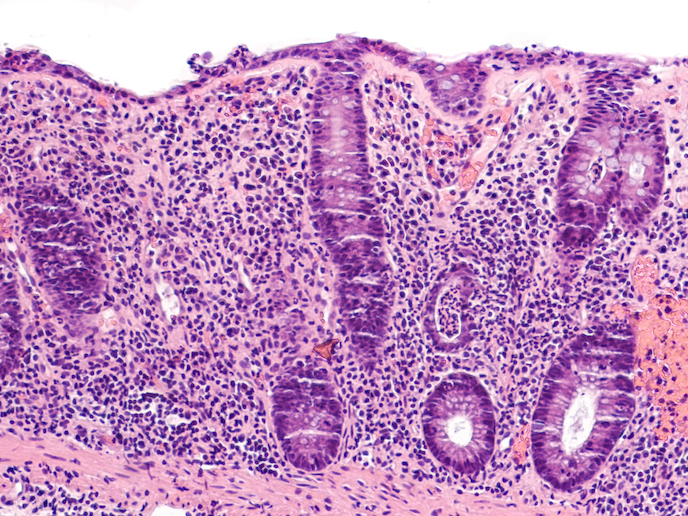
Nous savons depuis de nombreuses années que le microbiome intestinal — les milliards de bactéries qui coexistent avec les cellules humaines dans l’intestin — joue un rôle clé dans la santé humaine. Il a été démontré qu’il stimule l’immunité et notre métabolisme, et qu’il a même un impact sur les fonctions cérébrales. «La relation que nous entretenons avec notre microbiome est importante, mais aussi très fragile», remarque Harry Sokol, coordinateur du projet MArylAND, professeur de gastroentérologie à l’Hôpital Saint-Antoine et à l’Université de la Sorbonne à Paris, en France. «Plusieurs facteurs peuvent modifier cette relation. Nous savons par exemple que nos gènes peuvent avoir un impact sur la fonction et la composition du microbiome intestinal, mais que les facteurs environnementaux sont probablement encore plus importants.» Lorsque cette relation est altérée, nous pouvons devenir plus sensibles aux maladies. Celles-ci incluent les maladies inflammatoires de l’intestin (MII) comme la maladie de Crohn et la colite ulcéreuse. On estime que 3,4 millions de personnes rien qu’en Europe sont atteintes de MII, un groupe de troubles gastro-intestinaux chroniques invalidants qui peuvent avoir un impact sur tous les aspects de la vie d’un patient. «Environ un tiers des patients répondent bien au traitement, un tiers réagissent modérément et un tiers ne répondent pas du tout», explique Harry Sokol. «C’est pourquoi de nouvelles stratégies thérapeutiques sont nécessaires.»
Sensibilité à la maladie
Le projet MArylAND a été entrepris avec le soutien du programme Actions Marie Skłodowska-Curie. Il s’appuie sur des travaux antérieurs qui ont identifié un lien entre les variations d’un gène appelé CARD9, doté d’une sensibilité accrue aux MII. Bien que la possession de cette variation génétique ne conduise pas en elle-même à la maladie, elle peut augmenter le risque. «Dans le cadre de ce projet, nous avons examiné des souris présentant cette variation génétique et avons constaté qu’elles étaient plus sensibles à la colite», explique Harry Sokol. «Un facteur clé à cet égard était le microbiome. Fondamentalement, lorsque ce gène ne fonctionne pas correctement, le microbiome change en termes de composition et de fonction.» Harry Sokol a découvert qu’en prenant ce microbiome altéré et en le transférant à des souris avec le gène normal, on transférait également un certain degré de sensibilité. Harry Sokol a également lié la sensibilité à la colite avec le métabolisme d’un acide aminé essentiel appelé tryptophane. «La transformation de cet acide aminé par les bactéries intestinales produit des molécules qui activent des récepteurs dans nos cellules», explique Harry Sokol. «C’est important pour le processus de guérison et pour assurer la paix dans l’intestin.» Harry Sokol a découvert que les souris dépourvues du gène CARD9 produisaient moins de ces molécules, ce qui signifiait qu’elles activaient moins de récepteurs. Par la suite, cela les a rendues plus sujettes à la colite.
Mettre fin à un cercle vicieux
Ce projet a aidé Harry Sokol à répondre à la question de l’œuf et de la poule qui dérange les chercheurs depuis des années: savoir si les altérations du microbiome sont la cause ou la conséquence de la maladie. «Ce que ces travaux nous ont appris, c’est que ce n’est pas aussi simple que cela», dit-il. «Il y a clairement des facteurs responsables des modifications du microbiome. Ensuite, ces changements de comportement du microbiome ont eux-mêmes un effet délétère. Cela ressemble plus à un cercle vicieux.» En d’autres termes, s’il est parfaitement logique de poursuivre la recherche sur les thérapies basées sur le microbiome, dans de nombreux cas, le traitement du microbiome seul peut ne pas suffire. Afin de briser le cercle vicieux des MII, le personnel médical devra probablement arrêter l’inflammation suractivée et cibler le microbiome. Harry Sokol travaille actuellement à comprendre comment la fonction du microbiome est modifiée. «Si nous comprenons cela, nous pouvons essayer de corriger ce processus», remarque-t-il. «Je cherche à modifier le microbiome avec des greffes ou des probiotiques de nouvelle génération, mais aussi à mettre en place des traitements par immunosuppresseurs. Le but ultime est de développer de meilleurs traitements pour les patients.»
Mots‑clés
MArylAND, MII, colite, maladie de Crohn, intestin, intestinal, microbiome, gastroentérologie, acide aminé, cellules