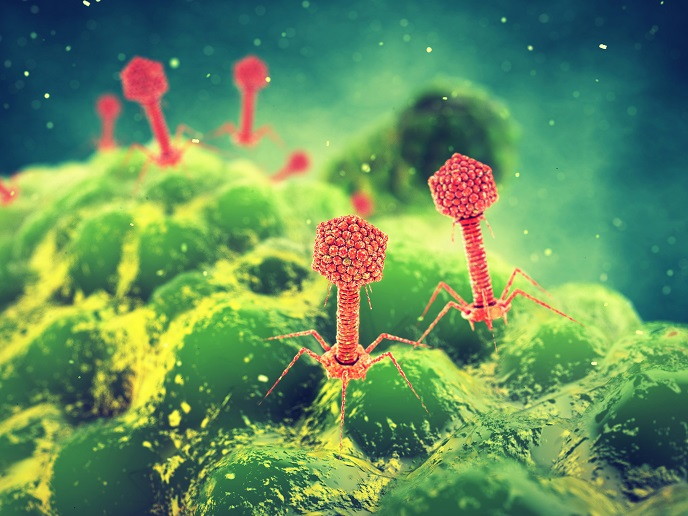
Les bactériophages peuvent-ils lutter contre la résistance aux antibiotiques?
Les bactériophages sont des virus qui ont besoin d’un hôte bactérien pour se reproduire; ils sont capables de transmettre du matériel génétique d’une bactérie à l’autre. Déchiffrer cette interaction s’avère essentiel au développement de stratégies efficaces impliquant des produits à base de bactériophages et de phages. Étudier les interactions entre bactéries et bactériophages à l’aide de la microfluidique Soutenu par le programme Marie Curie, le projet EvoMachine-Phage a été conçu pour comprendre les mécanismes sous-jacents de la coévolution antagoniste entre bactéries et bactériophages. Les travaux se sont concentrés sur le phénotype à haute densité cellulaire induite par le phage (PIHCD pour phage-induced high cell density), qui avait été observé auparavant par le Dr Steven Quistad, titulaire d’une bourse Marie Curie. Comme il l’explique, «le phénotype PIHCD a été observé après avoir mélangé des bactériophages prélevés d’un tas de compost à Paris contenant Pseudomonas fluorescens, une bactérie du sol fréquente». Même si ses prévisions indiquaient que le bactériophage devait tuer les bactéries ou entrer dans un état de latence dans les chromosomes de l’hôte, à sa grande surprise les bactéries infectées se sont mieux développées. Cette observation a incité ce chercheur du projet EvoMachine-Phage à étudier le mécanisme sous-jacent et à identifier les bactériophages responsables. Pour y parvenir, le Dr Quistad a exploité un nouveau dispositif microfluidique créé par MilliDrop, une entreprise dérivée du secteur de la biotechnologie fondée à l’https://www.espci.fr/fr/(ESPCI Paris). L’analyseur MilliDrop est un système entièrement automatisé, destiné à la culture et l’analyse de micro-organismes, permettant la croissance de bactériophages et de leurs hôtes dans des milliers de petites gouttelettes de la taille du sous-microlitre. La «machine de l’évolution», comme l’appelle le Dr Quistad, fournit d’excellentes conditions pour la croissance des bactéries, en maintenant les cellules bactériennes constamment en mouvement, et permet de sélectionner des gouttelettes d’intérêt et de les analyser. À l’aide de ce dispositif, le Dr Quistad et ses collègues ont étudié la répercussion de bactériophages individuels sur la physiologie de l’hôte et sont parvenus à identifier plusieurs candidats responsables du phénotype PIHCD. Les travaux en cours se concentrent sur l’identification de gènes candidats qui pourraient être responsables de ce phénotype. Les perspectives d’avenir de la microfluidique en microbiologie «Prouver l’utilité de la microfluidique dans la recherche sur les interactions phage/hôte a été, sans aucun doute, la réussite la plus importante du projet EvoMachine-Phage», signale le Dr Quistad. En outre, les opportunités inégalées en matière de collaboration interdisciplinaire offertes par l’ESPCI Paris se sont avérées essentielles au succès du projet. Cet institut a réuni des chimistes, des physiciens, des ingénieurs et des biologistes, tout en conservant des liens avec le secteur industriel. L’emploi de la microfluidique pour tester rapidement l’impact des bactériophages sur la physiologie de l’hôte pourrait se révéler utile dans un contexte clinique. La méthode de référence, utilisant des plaques, prend environ 48 heures pour isoler les bactériophages à partir d’un échantillon environnemental. Toutefois, lorsqu’il s’agit d’infections résistantes aux antibiotiques, pouvant se propager rapidement, l’accélération de l’isolation et de l’identification des bactériophages pourrait améliorer considérablement les résultats du traitement. Le dispositif MilliDrop serait susceptible de fournir plus rapidement des résultats significatifs sur le plan clinique. De plus, il pourrait être employé comme outil dans la lutte contre la résistance à plusieurs médicaments en analysant la virulence d’isolats de bactériophages spécifiques par rapport à des souches bactériennes d’intérêt. Le projet EvoMachine-Phage a fourni des connaissances fondamentales sur la physiologie des bactériophages et sur leur interaction avec les bactéries. En prenant en considération l’implication des bactériophages dans un éventail de processus biologiques, du cycle du carbone au maintien de la santé humaine, les résultats du projet devraient trouver des applications dans divers domaines en dehors des traitements à base de bactériophages.
Mots‑clés
EvoMachine-Phage, bactériophage, bactéries, microfluidique, MilliDrop, phénotype à densité cellulaire élevée induite par le phage (PIHCD), gouttelette, multirésistant, ESPCI Paris, résistance aux antibiotiques