Revelada la estructura tridimensional de un receptor de espermatozoides de mamíferos
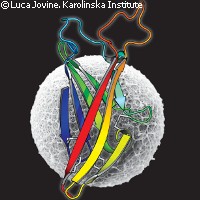
Científicos del Instituto Karolinska de Suecia han presentado la estructura tridimensional (3D) de una proteína involucrada de forma directa en la unión entre el óvulo y el espermatozoide. El descubrimiento tiene grandes implicaciones en la medicina reproductiva humana y puede emplearse en el desarrollo de novedosos anticonceptivos no hormonales. El estudio, financiado en parte por la UE mediante una prima europea de retorno Marie Curie, se ha publicado en la revista Nature. La cubierta del óvulo de los mamíferos, denominada zona pellucida (ZP), desempeña un papel fundamental en la fecundación e impide que penetre en el óvulo más de un espermatozoide. Ciertas proteínas de la ZP, denominadas ZP2 y ZP3, actúan como receptores de los espermatozoides en la fecundación. Contienen una secuencia común que les permite conformar la cubierta del óvulo, una matriz de filamentos que lo rodea por completo. Las proteínas ZP poseen una región denominada dominio ZP y las mutaciones en este dominio pueden provocar graves disfunciones, como la infertilidad, la sordera y ciertos tipos de cáncer. La estructura exacta de las proteínas que contienen el dominio ZP ha sido muy compleja de obtener debido a su naturaleza dinámica. Debido a esta complejidad estructural, el mero estudio de su secuencia de aminoácidos no habría bastado para describir con precisión las singulares características del dominio ZP. «La ZP3 se identificó hace casi treinta años, pero la obtención de información estructural de esta proteína reproductiva básica ha supuesto un reto técnico debido a su elevada heterogeneidad», según explicó el investigador principal Luca Jovine. En esta última investigación, los científicos describieron con elevada resolución la estructura tridimensional de una parte fundamental de la ZP3 mediante cristalografía de proteínas. Al revelar su estructura con un detalle sin precedentes, los investigadores mostraron que una parte de su dominio ZP, el ZP-N, se pliega de una manera novedosa que es semejante (pero claramente distinta) a la de los anticuerpos. Este trabajo demuestra que el ZP-N es un dominio por sí mismo y un subtipo diferenciado de la superfamilia de las inmunoglobulinas (IgSF). Esta superfamilia comprende un grupo de proteínas implicadas en los procesos celulares de reconocimiento, unión y adhesión. Los miembros comparten algunas características estructurales con los anticuerpos, incluido un dominio conocido como dominio (o plegamiento) inmunoglobulina. Estos dominios tienen una estructura formada por dos capas de cadenas beta. Los investigadores descubrieron que dos tercios de la ZP-N eran cadenas beta interconectadas por bucles de diversas longitudes y formas que conforman un bocadillo, similar al de las proteínas inmunoglobulinas pero con características propias. Los investigadores mantienen que sus métodos pueden utilizarse en futuros estudios para caracterizar una región de la ZP3 importante para la polimerización. Un logro semejante ampliaría de forma sustancial los conocimientos que poseemos sobre la fertilidad humana. Puede también desembocar en el desarrollo de nuevos anticonceptivos no hormonales dirigidos. «La fertilización mamífera se produce por una serie extremadamente complicada de mecanismos. Nuestros descubrimientos allanan el camino para continuar realizando investigaciones en este fascinante tema, al haber aportado una impresión preliminar del comienzo de la vida a resolución atómica», declaró el Dr. Jovine. La descripción de la ZP-N también permitió conocer la base molecular de las enfermedades humanas relacionadas con la ZP. «La estructura de la ZP-N de la ZP3 proporciona una primera impresión de la base del proceso de fecundación en mamíferos a resolución atómica», concluye el estudio. «Debido a que numerosas mutaciones patológicas en proteínas de dominio ZP se enmarcan en la ZP-N, este trabajo no sólo tendrá importancia para la medicina reproductiva, sino también para [el tratamiento de] enfermedades humanas graves como la sordera no sindrómica o los trastornos vasculares o renales.»
Países
Suecia