Des chercheurs percent le secret du code de l'ADN des spermatozoïdes
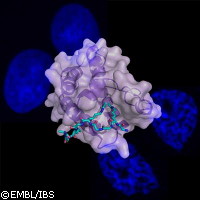
Une équipe de chercheurs européens du Laboratoire européen de biologie moléculaire (LEBM) à Heidelberg (Allemagne) et Grenoble (France) a découvert qu'une protéine uniquement présente dans les spermatozoïdes, Brdt, dirigeait le reconditionnement de l'ADN du sperme. Les résultats de leur étude, publiés dans la revue Nature, révèlent l'origine de l'hydrodynamisme des spermatozoïdes. En collaboration avec leurs collègues de l'Institut de biologie structurale (IBS) - Jean Pierre Ebel et de l'Institut Albert Bonniot (IAB) en France, les chercheurs du LEBM ont découvert une nouvelle façon de lire le code des histones en élucidant le mystère de l'ADN des spermatozoïdes. Une chose est sûre: la vitesse à laquelle les spermatozoïdes nagent est cruciale pour la fertilité. L'ADN (acide désoxyribonucléique) est une molécule longue et encombrante. Par commodité, il est donc conditionné en une structure complexe appelée chromatine, qui constitue la structure fondamentale du chromosome. Les longs brins d'ADN s'enroulent autour de protéines appelées histones. Mais quelle est la caractéristique qui rend l'ADN des spermatozoïdes unique? Les chercheurs expliquent que la chromatine des spermatozoïdes est encore plus compacte, et la tête des spermatozoïdes s'en trouve réduite et profilée. Les études ont montré que la nature de la chromatine obéit à une régulation très complexe. Les histones sont marquées par différentes étiquettes chimiques, lesquelles agissent comme un code dirigeant les changements dans la structure de la chromatine. Selon les chercheurs, «ces étiquettes sont reconnues par différentes protéines qui s'y fixent et dont la combinaison permet de déchiffrer efficacement le code des histones.» Les recherches antérieures avaient suggéré que ces protéines se fixaient par l'un ou plusieurs de leurs «domaines» modulaires, chacun se liant à une seule étiquette. Mais les scientifiques du LEBM, de l'IBS et de l'IAB ont mis en évidence l'existence d'un niveau supplémentaire de sophistication. Ils ont étudié la fixation sur les histones d'une protéine appelée Brdt, pour découvrir que celle-ci se lie fortement à une histone comportant deux motifs d'une étiquette particulière (dans ce cas, des groupements acétyle, des groupes contenant de l'hydrogène et du carbone), et que cette liaison n'est assurée que par un seul domaine. «Nous avons été très surpris», explique Christoph Müller du LEBM. «En examinant la structure, nous avons constaté que le domaine forme une poche se liant à deux étiquettes en même temps.» Pour sa part, le Dr Saadi Khochbin de l'IAB explique: «Juste avant que l'ADN du spermatozoïde ne commence à s'hypercompacter, ces étiquettes sont ajoutées dans toute la chromatine en une énorme vague. Si la protéine Brdt est absente, le compactage supplémentaire n'a pas lieu, et la tête du spermatozoïde est moins hydrodynamique. Les souris mâles privées de Brdt sont infertiles.» Néanmoins, les chercheurs ne peuvent que supposer que la façon particulière dont Brdt se lie aux étiquettes des histones est importante pour sa capacité à compacter la chromatine. «L'une des idées est que les histones acquièrent les étiquettes de façon séquentielle et qu'elles ne deviennent compactes qu'une fois toutes les étiquettes présentes», explique le Dr Müller. «Brdt se fixe aux deux dernières étiquettes dans cette séquence, ce qui fait de la fixation de Brdt la toute dernière étape de ce processus, le signal final de lancement de l'hypercompactage.» Carlos Petosa, de l'IBS, ajoute: «Nous avons réexaminé les structures d'autres protéines qui s'associent à la chromatine, pour découvrir que ce mécanisme de reconnaissance d'étiquettes pourrait se vérifier pour elles aussi, [ce qui] élargit notre compréhension du mécanisme de lecture du code des histones.» Les chercheurs estiment que leurs travaux permettront de mieux comprendre certains problèmes rencontrés lors du développement des spermatozoïdes, et cherchent à identifier comment cette protéine est impliquée dans l'infertilité masculine.
Pays
Allemagne, France