Nowy lek pozwoli wytropić MRSA w najdalszych zakątkach
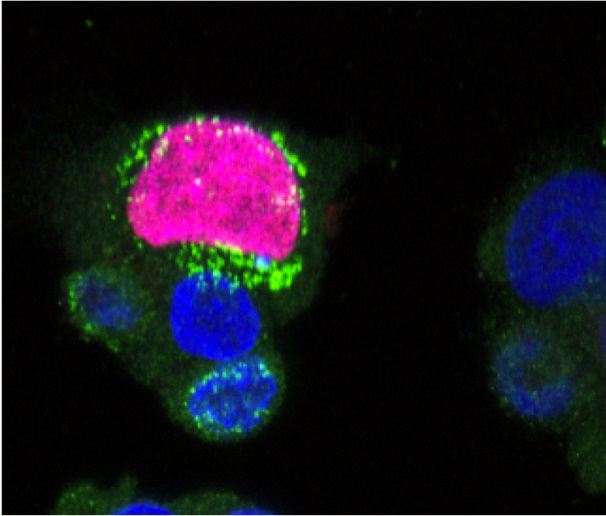
Na przestrzeni lat, gronkowiec złocisty, w szczególności w swojej postaci opornej na metycylinę (MRSA), nabrał niechlubnej sławy jednej z najgorszych konsekwencji hospitalizacji. Jednakże, inna jego postać, pozaszpitalne szczepy S. aureus oporne na metycylinę (CA-MRSA), stała się jeszcze groźniejsza i zjadliwa, dotykająca skądinąd zdrowych ludzi, szczególnie w Ameryce Północnej. Zazwyczaj choroba zajmuje skórę oraz tkanki miękkie. Wywołuje miejscowe ropnie, leczone antybiotykami, na których działanie MRSA nadal wykazuje podatność - czyli wankomycyną lub ryfampicyną. Niemniej w niektórych przypadkach, MRSA przeobraża się w chorobę martwiczą (martwicze zapalenie powięzi), a gdy uzyska dostęp do krwiobiegu, rozsiewa się w całym organizmie. W takich przypadkach, śmiertelność zwiększa się do 30%. „MRSA uważa się za „super bug” ze względu na wykazywaną przez niego oporność na antybiotyki, chociaż ja nazywam go w ten sposób z innego powodu: z uwagi na jego zdolność do unikania odpowiedzi odpornościowej nieswoistej” - mówi dr Bas Surewaard, który koordynował projekt PSMS-IN-INFLAMMATION z ramienia UMC Utrecht. „Gronkowiec ma doprawdy imponujący arsenał czynników zjadliwości, które zasadniczo wykazują zdolność uniknięcia i/lub zabicia wszystkich komórek odpornościowych organizmu. Nawet po pochłonięciu przez fagocyty, co dla większości bakterii oznacza szybkie unicestwienie, MRSA ma w zanadrzu wiele mechanizmów, zaprojektowanych, by stawić opór i rozmnożyć się w tak szkodliwym środowisku”. To oznacza, że żadna szczepionka nie wypleni MRSA i konieczne jest dalsze zbadanie jego czynników zjadliwości. Co znamienne, jedynie niewielką liczbę czynników zjadliwości przypisuje się CA-MRSA. Rozpuszczalne w fenolu moduliny (PSM) są jednym z nich, a dr Surewaard pierwotnie zamierzał wnikliwie zbadać ich funkcje. Dokonał tego, wykorzystując najnowocześniejszą technikę nazywaną przyżyciową mikroskopią konfokalną z wirującym dyskiem (ang. spinning-disk confocal intravital microscopy, SD-IVM), którą można zastosować na potrzeby śledzenia w czasie rzeczywistym odpowiedzi odpornościowej na bakterię u żywych, znieczulonych myszy. „Ta technika ma wielki potencjał, gdyż łączy możliwość lokalizacji i pomiaru czasu odpowiedzi odpornościowej i żywych zwierząt. Niestety, nasz pierwotny cel, polegający na zbadaniu roli modulin PSM w zakażeniach skóry, okazał się zbyt trudny za pomocą obrazowania skóry, gdyż kolagen i tłuszcz uniemożliwiły nam pozyskanie istotnych danych za pomocą techniki SD-IVM. Dlatego skoncentrowaliśmy się na zakażeniach krwi gronkowcem oraz ich wpływie na wątrobę” tłumaczy dr Surewaard. Po wprowadzeniu MRSA do krwiobiegu, dr Surewaard odkrył, że 90% bakterii zostało uwięzionych przez wyspecjalizowane makrofagi, znajdujące się w wątrobie - komórki Kupffera. Wysiłki badawcze skupił więc na ustaleniu czy te bakterie są zdolne przeżyć w komórkach Kupffera, czy ulegają unicestwieniu, oraz jaki mechanizm odpowiada za to zjawisko. „Odkryliśmy, że 90% MRSA pochłoniętych przez komórki Kupffera ulega unicestwieniu w przeciągu pierwszych 8 godzin od zakażenia dzięki reaktywnym formom tlenu (ROS). Jednakże, pozostałych 10% potrafi przetrwać atak ze strony komórek Kupffera i zaczyna się rozmnażać wewnątrz nich. To tam są chronione przed antybiotykami ostatniej szansy, takimi jak wankomycyna. To może być wytłumaczenie, dlaczego w warunkach klinicznych pacjentów trzeba poddać dwu- do sześciotygodniowemu leczeniu wankomycyną, a w badaniu w próbówce bakterie zostają zabite w ciągu kilku godzin” mówi dr Surewaard. Od tej pory, zastanawiał się jak można dostarczyć antybiotyki do wnętrza tych komórek. Rozwiązaniem okazały się liposomy (pęcherzyki tłuszczu), naszpikowane wankomycyną, które dr Surewaard nazwał wankosomami. Te wankosomy zostały z powodzeniem przyswojone przez komórki Kupffera, zabijając znajdujące się wewnątrz nich bakterie MRSA i zapobiegając rozprzestrzenieniu się bakterii na inne narządy. Jakkolwiek wankosomy można uznać za „dowód słuszności koncepcji” leku, dr Surewaard połączył siły z ośrodkiem Centre for Drug Research and Development (CDRD) w Vancouver, w Kanadzie, by opracować i wprowadzić do obrotu rynkowego nowe postaci liposomalne lub nanocząstkowe z myślą o skuteczniejszym dostarczeniu antybiotyku do wnętrza komórek Kupffera. Jego ostatecznym zamiarem jest wyleczenie pacjentów z zakażeniami gronkowcem dzięki swoim badaniom oraz przekonanie wspólnoty naukowej o istnieniu składników wewnątrzkomórkowych MRSA oraz konieczności ich unicestwienia.
Słowa kluczowe
PSMS-IN-INFLAMMATION, komórki Kupffera, gronkowiec złocisty, gronkowiec złocisty oporny na metycylinę (MRSA), pozaszpitalne szczepy S. aureus oporne na metycylinę (CA-MRSA), metycylina, antybiotyki, wankomycyna, reakcja układu odpornościowego, fagocyty, rozpuszczalne w fenolu moduliny (PSM), wątroba, bakterie